Zwei Kohlenstoff-Atome binden sich
 Ethan ist einer der einfachsten organischen Verbindungen, dessen Moleküle aus zwei Kohlenstoff-Atome bestehen, die miteinander mit einer Einfachbindung gebunden sind. An jedem Kohlenstoff-Atom sind drei Wasserstoff-Atome gebunden.
Ethan ist einer der einfachsten organischen Verbindungen, dessen Moleküle aus zwei Kohlenstoff-Atome bestehen, die miteinander mit einer Einfachbindung gebunden sind. An jedem Kohlenstoff-Atom sind drei Wasserstoff-Atome gebunden.
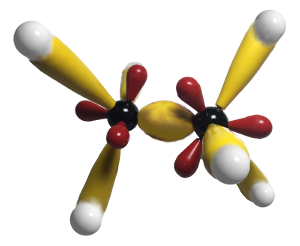
Beide Kohlenstoff-Atome sind sp3-hybridisiert (vergleiche hierzu auch Methan). Oder genauer gesagt: Beide Kohlenstoff-Atome besitzen jeweils vier identische sp3-Hybrid-Orbitale, die für Bindungen zur Verfügung stehen, da sie jeweils nur mit einem Elektron besetzt sind.
Jeweils ein sp3-Hybrid-Orbital wird für die Bindung zwischen den beiden Kohlenstoff-Atomen benutzt. Jeweils drei sp3-Hybrid-Orbitale werden für die Bindung zu den s-Orbitalen der Wasserstoff-Atome benutzt.
Im Ethan-Molekül liegen also folgende Bindungen vor:
- Sechs s-sp3-σ-Bindungen (zwischen den Wasserstoff-Atomen und den Kohlenstoff-Atomen).
Diese Bindungen entstehen nach dem gleichen Schema, wie wir es schon beim Methan gesehen haben:
- Eine sp3-sp3-σ-Bindung (zwischen den beiden Kohlenstoff-Atomen).
Die sp3-sp3-σ-Bindung entsteht nach folgendem Schema:
Alle Bindungen sind drehbar bzw. rotationssymmetrisch. Infolge der Drehbarkeit der sp3-sp3-σ-Bindung können die Wasserstoff-Atome beider Kohlenstoff-Atome zueinander unterschiedliche Stellungen aufweisen. Hierbei ist die sogenannte staffelte Stellung - wie hier in der Abbildung - die bevorzugte, da die Wasserstoff-Atome den größt möglichsten Abstand zueinander haben.

Solche räumliche Anordnungen der Atome im Molekül nennt man Konformation. Bei der gestaffelten Konformation haben die Atome den größt möglichsten Abstand zueinander, bei der sogenannten ekliptischen Konformation stehen sie gegenüber.
Newman-Formel der gestaffelten Konformation: 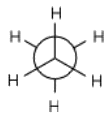





Kommentare
Der Link dazu ist:
http://www.youtube.com/watch?v=y6SnBVpLkJw