Chromophore
Die Farbigkeit von Pigmenten (siehe letztes Kapitel) beruht auf anderen strukturellen Gegebenheiten, als die Farbigkeit, die bei löslichen Farbstoffen zu beobachten ist.
Begriffsklärung:
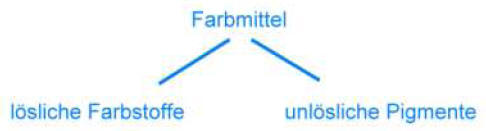
Farbmittel sind Stoffe, die alle Eigenschaften haben, um daraus Farben bereiten zu können,
oder die zum Färben geeignet sind.
Man unterscheidet Farbstoffe und (Farb-) Pigmente:
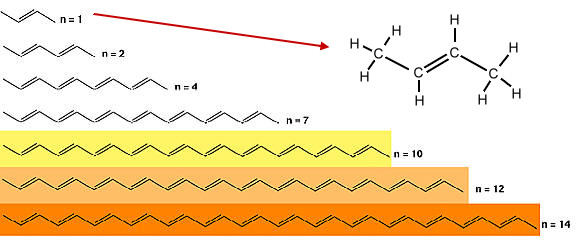
Die Struktur von Farbstoffmolekülen lässt sich einfach an den Polyenen zeigen. Polyene sind Kohlenwasserstoffe mit mehreren Doppelbindungen (Dien, Trien ... Polyen). Bei den obigen Beispielen bedeutet "n" die Anzahl der Doppelbindungen.
Es fällt auf, dass Polyene, die mehr als neun konjugierte Doppelbindungen besitzen, uns farbig erscheinen.
Vergegenwärtigen wir uns einmal, was es mit diesen konjugierten Doppelbindungen auf sich hat.
Lesen Sie bitte unbedingt das Kapitel Bindungsverhältnisse beim Butadien (Unterrichtsinhalt aus dem 1. Halbjahr) und kehren Sie dann hierher zurück! Dort wird der Begriff Mesomerie (Resonanz) erklärt und beschrieben, wie man mesomere Grenzformeln aufstellt. Sie brauchen das für dieses Thema hier!
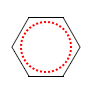
Fazit aus der Lektüre: Bei einer Doppelbindung sind zwei Elektronen relativ leicht zu verschieben bzw. zu verteilen, wenn eine konjugierte andere Doppelbindung (oder/und ein nicht bindenden Elektronenpaar) in der Nähe ist. Bei konjugierten Doppelbindungssystemen verteilen sich diese so genannten π-Elektronen über das ganze System. Diese Vorstellung ist auch ohne der Kenntnis von der Orbitaltheorie plausibel. Das klassische Beispiel hierfür ist Benzol:
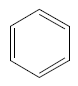
Wahrscheinlicher:
rot = delokalisiertes π-Elektronensystem!
Doch welcher Zusammenhang besteht nun zwischen der Farbigkeit und der Länge eines konjugierten Doppelbindungssystems?
Stellen Sie sich ein kurzes Molekül mit delokalisierten π-Elektronen vor, bei dem alle Kohlenstoff-Kohlenstoff-Bindungen gleichwertig sind. Und stellen Sie sich nun vor, Sie könnten das Molekül wie eine Gitarrensaite anschlagen und damit zur Schwingung bringen. Man benötigt relativ viel Kraft um eine kurze Saite zur Schwingung zu bringen. Weniger Kraft braucht man um eine lange Saite zum Schwingen zu bringen. Oder: stellen Sie sich ein kurzes und ein langes Springseil vor, welche mit einem Ende an einer Wand befestigt sind. Wie viel Energie benötigen Sie bei den unterschiedlichen Seilen, um eine (stehende) Welle zu erzeugen?. Die benötigte Energie wird mit zunehmender Länge geringer. Analog hierzu kann man sagen:
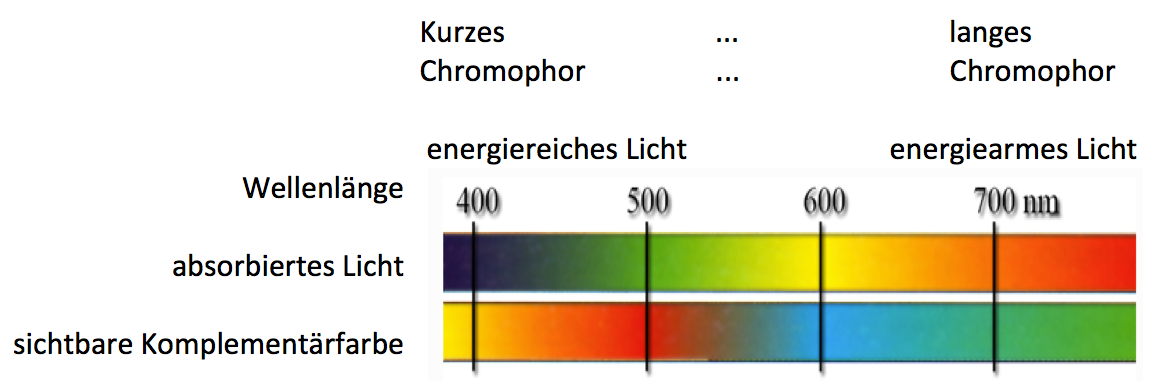
 Moleküle mit einem langen delokalisierten π-Elektronensystem können langwelligeres, also energieärmeres Licht im sichbaren Bereich absorbieren, kurzkettige Moleküle mit einem kurzen delokalisierten π-Elektronensystem hingegen können kurzwelliges, also energiereicheres Licht, also ultraviolettes, nicht sichtbares Licht absorbieren.
Moleküle mit einem langen delokalisierten π-Elektronensystem können langwelligeres, also energieärmeres Licht im sichbaren Bereich absorbieren, kurzkettige Moleküle mit einem kurzen delokalisierten π-Elektronensystem hingegen können kurzwelliges, also energiereicheres Licht, also ultraviolettes, nicht sichtbares Licht absorbieren.
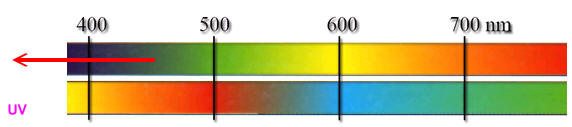
Die von uns Menschen wahrgenommene Farbe eines Gegenstandes ergibt sich aus der Mischung der von ihm nicht absorbierten Lichtanteile des weißen, sichtbaren Lichts.
Beispiele für Farbstoffe der Natur
Beispiel 1
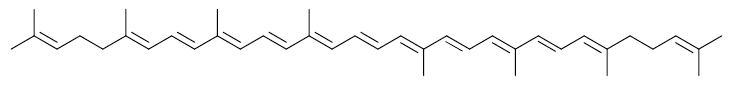
Folgender Farbstoff ist entsprechend seines langen delokalisierten π-Elektronensystems rot. Dieser Farbstoff heißt Lycopin (Lycopen). Man findet ihn in Tomaten und Hagebutten.
Beispiel 2

In lebenden Hummern sind diese Farbstoffmoleküle an ein Protein gebunden, wobei sich immer zwei in einer X-Form kreuzen und dadurch das delokalisierte π-Elektronensystem erweitert wird. Gelbes Licht wird absorbiert, wir sehen die Komplementärfarbe blau. Beim Kochen werden die Farbstoffmoleküle frei, und es erfolgt ein intensiver Farbumschlag von blau (Absorption: λmax = 632 nm) nach rot (Absorption: λmax ~ 480 nm).
(Oberer Balken: Absorbiertes Licht,
unterer Balken: Komplementärfarbe)
Beispiel 3
β-Carotin (Absorption: λmax = 460 nm)

Um die ausführlichere Strukturformel zu sehen, müssen Sie mit der Maus auf das Bild zeigen.
β-Carotin lässt sich leicht aus Mohrüben isolieren:
Wenn man das gelbe-orangefarbene β-Carotin mit Brom reagieren lässt, dann werden Doppelbindungen durch die Addition von Brom-Atomen in Einfachbindungen umgewandelt. Das geschieht nicht mit einem mal, sondern allmählich.
Siehe auch: Bromierung von Alkenen, Reaktionsmechanismus der elektrophile Addition, AE, (Leistungskurs) 
Demzufolge müsste eine Farbveränderung von gelb zu farblos zu erwarten sein, da ein kürzeres delokalisiertes π-Elektronensystem energiereichere, also kurzwelligere elektromagnetische Strahlung jenseits des sichtbaren Lichtes absorbiert:
Dem ist auch so!
Zusammenfassung
 Normalerweise reicht die Energie des Lichts nicht aus, um die Elektronen eines Moleküls anzuregen. In einem delokalisierten π-Elektronensystem (konjugierte Doppelbindungen) wird jedoch die zur Anregung der π-Elektronen notwendige Energie soweit erniedrigt, dass die Energie des sichtbaren Lichts zur Anregung ausreichen kann. Bei der Anregung dieser Elektronen wird ein Teil des Lichtes absorbiert. Die nicht absorbierten Anteile des sichtbaren Lichtes ergeben in der Mischung die für uns wahrnehmbare Komplementärfarbe.
Normalerweise reicht die Energie des Lichts nicht aus, um die Elektronen eines Moleküls anzuregen. In einem delokalisierten π-Elektronensystem (konjugierte Doppelbindungen) wird jedoch die zur Anregung der π-Elektronen notwendige Energie soweit erniedrigt, dass die Energie des sichtbaren Lichts zur Anregung ausreichen kann. Bei der Anregung dieser Elektronen wird ein Teil des Lichtes absorbiert. Die nicht absorbierten Anteile des sichtbaren Lichtes ergeben in der Mischung die für uns wahrnehmbare Komplementärfarbe.
Der Teil des Moleküls, der für die Farbgebung verantwortlich ist, wird Chromophor (griechisch: chroma = Farbe) genannt.
Je länger ein Chromophor ist, desto energieärmeres Licht (größere Wellenlänge, kleinere Frequenz) kann es absorbieren.