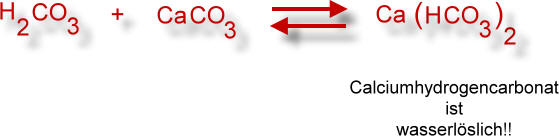
Kohlensäurehaltiges Wasser reagiert mit Calciumcarbonat

Du kippst versehentlich auf einer Party ein Sektglas auf einem Marmortisch um. Der Gastgeber, der dich dabei beobachtet hat, spricht dich am nächsten Tag an und fragt dich, warum du den Sekt nicht gleich aufgewischt hast. Nun wäre der Marmortisch an dieser Stelle stumpf. Die Oberfläche sei rau und porös.
Lizenfreie Fotos und Cliparts
Dieses einfache Reaktionsschema in Symbolformelschreibweise drückt den Zusammenhang nur unvollständig aus. Folgendes Reaktionsschema in Ionenformelschreibweise schließt mehr Informationen ein:
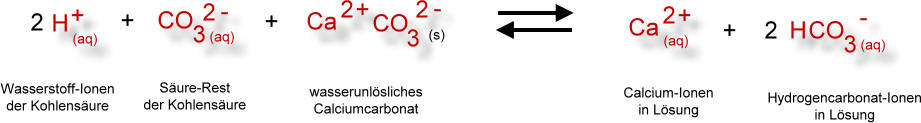
Dieser Umwandlungsprozess von Calciumcarbonat (Kalk) zu Calciumhydrogencarbonat ist auch ein Grund für die "Verwitterung" von Denkmälern aus Kalkstein oder Marmor. Dies wurde schon im Thema "Saurer Regen" angesprochen.
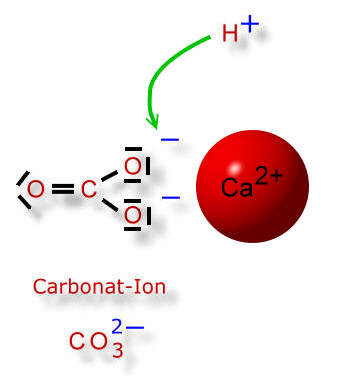
Doch wieso werden beim Calciumcarbonat die Ionen nicht durch Wassermoleküle aus ihrem Ionengitter gelöst?
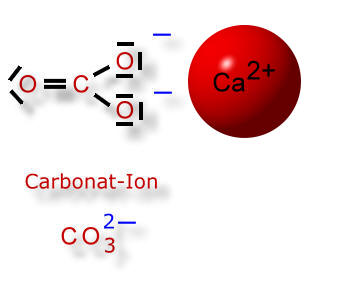
Wie wir gelernt haben, dissoziiert die Kohlensäure in zwei Schritten, wobei es sich immer um Gleichgewichtsreaktionen handelt. So kann ein Carbonat-Ion auch wieder ein Wasserstoff-Ion (=Proton) aufnehmen. Dann entsteht ein Hydrogencarbonat-Ion, das nur einfach negativ geladen ist:
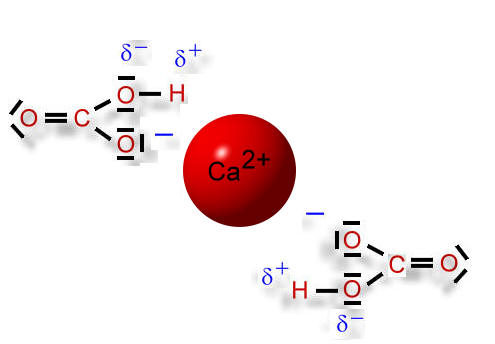
An dem einem 2-fach positiv geladenen Calcium-Ion können sich zwei einfach negativ geladene Hydrogencarbonat-Ionen anlagern. Diese "hängen" - jedoch aufgrund ihrer einfachen Ladung - nicht so fest am Calcium-Ion. Wassermoleküle können nun die Ionen voneinander trennen und anschließend umhüllen (Hydratation), so dass sich die Ionen nicht mehr anziehen können und frei beweglich im Wasser "umherschwimmen" können.