Eine Säure, die es eigentlich gar nicht gibt!
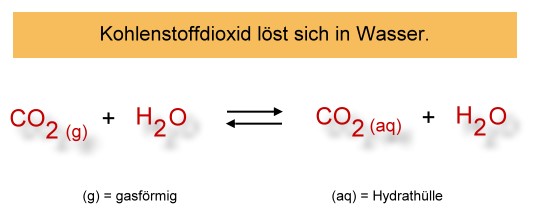
Das Gas Kohlenstoffdioxid löst sich gut in Wasser (ca. 1 Liter Kohlenstoffdioxid in 1 Liter Wasser bei Raumtemperatur und Normaldruck). Dies ist ein physikalischer Vorgang (es entstehen zunächst keine neuen Stoffe):
Von einer Hydrathülle zu sprechen ist ein wenig übertrieben, denn die Kohlenstoffdioxid-Moleküle werden nur sehr locker an die Wassermoleküle gebunden.
Man kann sich das folgendermaßen vorstellen:
Durch Schütteln kann man die Kohlenstoffdioxid-Moleküle von den Wassermolekülen lösen. Jeder kennt das, wenn man eine Colaflasche vor dem Öffnen schüttelt.
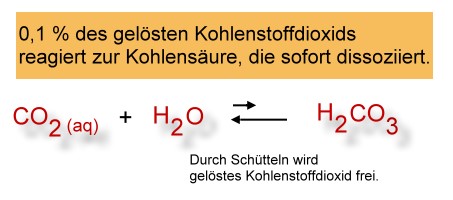
Ein Bruchteil (ca. 0,1 %) der Kohlenstoffdioxidmoleküle, die im Wasser gelöst sind, reagiert tatsächlich mit Wasser zur Kohlensäure:
Beachte den Gleichgewichtspfeil!
Die Kohlensäure existiert nur für wenige Nanosekunden - dann zerfällt sie wieder in Kohlenstoffdioxid und Wasser bzw. in Wasserstoff-Ionen und den Säureresten der Kohlensäure (siehe nächstes Thema).
Die Strukturformel der Kohlensäure:
Aufgrund des natürlich vorkommenden Kohlenstoffdioxidgehaltes in der Luft besitzt unbelastetes Regenwasser einen pH-Wert von ca. 5,6. Unser Regenwasser enthält "Kohlensäure".
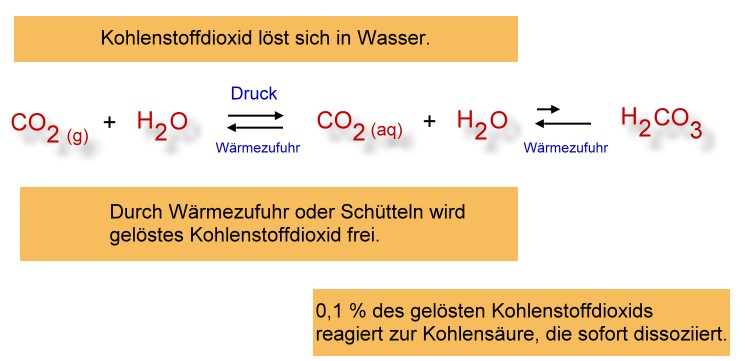
Durch eine Temperaturerhöhung verschiebt sich das oben beschriebene Gleichgewicht noch weiter nach links: Es entsteht vermehrt das Gas Kohlenstoffdioxid, da sich - aufgrund der heftigeren Bewegung der Moleküle - die Kohlenstoffdioxid-Moleküle nicht mehr an den Wassermolekülen "festhalten" können. Man kann auch sagen: Je wärmer das Wasser ist, desto weniger kann Wasser Kohlenstoffdioxid lösen.
Da das Kohlenstoffdioxid aus dem System entweicht, wird die Gleichgewichtsverschiebung nach links verstärkt, so dass immer mehr Kohlensäure verbraucht wird.
- Das Schülerexperiment: Erhitzen von kohlensäurehaltigem Wasser verdeutlicht dies:
- Im Sommer bläht sich eine Coladose am Boden auf, die Mineralwasserflasche zischt beim Öffnen lauter.
- Das "Austreiben" von Kohlenstoffdioxid funktioniert auch durch raue Flächen oder kantige Kristalle, insbesondere bei großer Oberfläche. In guten Sektgläsern ist z.B. am Boden das Glas in einem Punkt aufgeraut. Hier perlt das Kohlenstoffdioxid sehr schön aus.
Hintergrund: An der rauen Oberfläche lagert sich Kohlenstoffdioxid zu immer größer werdenden Blasen zusammen, die sich schließlich von der Oberfläche lösen und aufsteigen.
Einen extremen Fall beobachtet man beim Cola-Mentos-Versuch (siehe unten).
Durch Druckerhöhung verschiebt sich das Gleichgewicht nach rechts:
Mit einer Sodamax-Flasche kann man Kohlenstoffdioxid in Leitungswasser pressen. Die kohlenstoffdioxidhaltige Lösung schmeckt sauer.
Durch das Hineinpressen von CO2 wird vermehrt Kohlensäure gebildet. Der pH-Wert verschiebt sich in den sauren Bereich (Universalindikator: orange/rot). Da Kohlensäure eine schwache Säure ist, erreicht man nur einen pH-Wert von ca. 6-5 (orange).