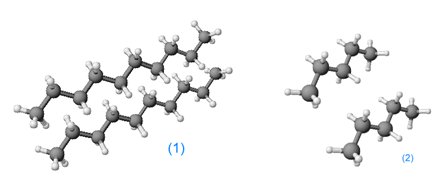
van-der-Waals-Kräfte
Erläuterung für die unterschiedlichen Siedepunkte in der homologen Reihe der n-Alkane
Zwischen unpolaren Atomen und Molekülen treten schwache Anziehungskräfte auf. Diese schwachen zwischenmolekularen Kräfte kommen durch kurzzeitige, zufällige Verschiebungen von Elektronen zustande. Durch diese temporären Verschiebungen treten kurzzeitige Ladungsverschiebungen auf (temporäre Dipole bzw. Partialladungen). Diese Ladungsverschiebungen beeinflussen auch benachbarte Atome insofern, als sie dort auch für eine Ladungsverschiebung sorgen (induzierte Dipole). Diese hier beschriebenen, sehr schwachen zwischenmolekularen Kräfte zwischen unpolaren Atomen und Molekülen nennt man nach dem Entdecker van-der-Waals-Kräfte.
Das gleiche gilt natürlich auch für die Schmelztemperatur.
(1) = Große Molekülmasse, große Berührungsfläche => große van-der-Waals-Kraft
(2) = Kleine Molekülmasse, kleine Berührungsfläche => kleine van-der-Waals-Kraft
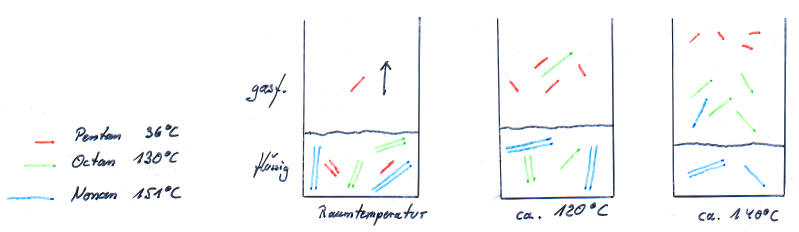
Folgende Zeichnungen zeigen ein Gedankenexperiment, bei dem ein Gemisch aus den Stoffen n-Pentan, n-Octan und n-Nonan langsam erhitzt wird.
Die Moleküle mit geringer Molekülmasse können sich nicht so stark anziehen, als die Moleküle, die größer sind.
Das kann man technisch ausnutzen, um ein solches Gemisch zu trennen (siehe: Die fraktionierende Destillation).
Es gibt noch eine andere zwischenmolekulare Kraft, die noch einen größeren Effekt auf die Siedetemperatur hat. Es ist die gleiche Kraft, die du schon bei den Wasser-Molekülen kennengelernt hast: Die "Wasserstoffbrücken". Sie spielen nicht nur beim Wasser eine wichtige Rolle, sondern auch bei den Alkoholen.