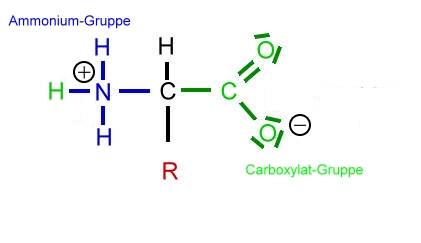
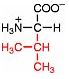
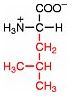
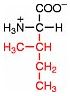
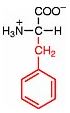
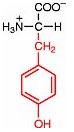
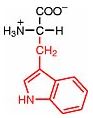
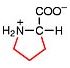
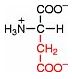
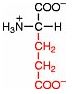
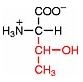
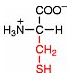
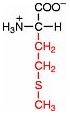
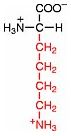
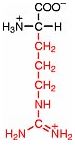
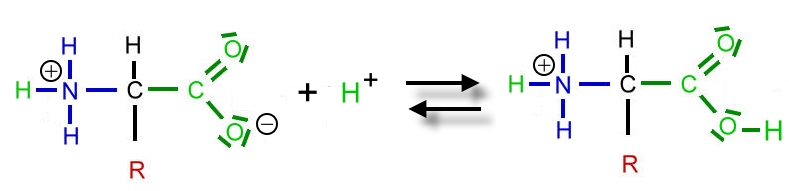Saure Carboxy-Gruppe und basische Amino-Gruppe
Nach Brönsted sind Säuren Stoffe, die Wasserstoff-Ionen (Proton) abgeben können. Dafür ist aber auch die Anwesenheit eines Stoffes nötig, der dieses Wasserstoff-Ion aufnehmen kann.
Nach Brönsted ist eine Base ein Stoff, der Wasserstoff-Ionen, also Protonen, aufnehmen kann. Dazu bedarf es vor allem mindestens eines freien Elektronenpaares. Denn dieses "freie" Elektronenpaar kann mit einem Proton eine Bindung eingehen.
Eine Aminosäure besitzt beide Merkmale:
-
Eine basiche Amino-Gruppe und
-
eine saure Carboxy-Gruppe.
Bildung eines Zwitter-Ions
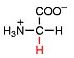
Ein abgespaltenes Wasserstoff-Ion (Proton) aus der Carboxy-Guppe wandert zur Amino-Gruppe und bildet dort eine Ammonium-Gruppe. Gleichzeitig entsteht aus der Carboxy-Gruppe eine Carboxylat-Gruppe. Das dynamische Gleichgewicht liegt weit auf der rechten Seite. Es ist ein Zwitter-Ion entstanden. Der Stoff bildet ein Ionengitter aus.
Wasser ist so ein Ampholyt:
Je nach Reaktionspartner kann Wasser Protonen aufnehmen
H2O + H+oder abgeben
H2OZwischen zwei Molekülen eines Ampholyts können Protonen (Wasserstoff-Ionen) übertragen werden. In solch einem Fall spricht man von Autoprotolyse.
H2O + H2O
Als Zwitter-Ion kann eine Aminosäure sowohl Protonen abgeben (= Brönsted-Säure, Protonendonator) als auch Protonen aufnehmen (= Brönsted-Base, Protonenakzeptor). Somit sind Aminosäuren Ampholyte.
Aminosäure in der Säure-Funktion:
In wässriger Lösung kann das Zwitter-Ion den Wassermolekülen ein Proton abgeben. Es entsteht das Anion der Aminosäure und ein Oxonium-Ion (saure Lösung):
AS+- + H2O ![]() AS- + H3O+
AS- + H3O+
Gibt man zu einer Aminosäurelösung eine Lauge, so stellt man fest, dass sich der pH-Wert kaum ändert. Die Hydroxid-Ionen (OH--Ionen) werden sozusagen weggepuffert. Das liegt daran, dass die Aminosäure Wasserstoff-Ionen abgeben kann und sich auf diese Art mit den Hydroxid-Ionen Wasser bildet
Aminosäure in der Base-Funktion:
In wässriger Lösung kann das Zwitter-Ion von einem Oxonium-Ion ein Proton aufnehmen. Es steht das Kation der Aminosäure und Hydroxid-Ionen (=> alkalische Lösung):
AS+- + H3O+ ![]() AS+ + OH-
AS+ + OH-
Eine Aminosäure-Lösung kann auf diese Weise als Puffer für Wasserstoff-Ionen (bzw. Oxonium-Ionen) dienen: Die Hydroxid-Ionen bilden mit den Wasserstoff-Ionen Wasser. Der pH-Wert ändert sich also bei Zugabe einer Säure kaum.
Wie groß das Bestreben der funktionellen Gruppen ist, Protonen aufzunehmen bzw. abzugeben, hängt von der Beschaffenheit der Seitenkette der Aminosäure ab. Zwar liegen Aminosäuren vom chemischen Gleichgewicht her hauptsächlich als Zwitter-Ionen vor, doch es ist eben "nur" ein Gleichgewicht. Gibt man eine Aminosäure ins Wasser, so stellt sich ein für die Aminosäure charakteristischer pH-Wert ein, je nachdem, ob die Aminosäure einige Protonen abgibt oder aufnimmt bzw. wie viele. Diesen charakteristischen pH-Wert nennt man isoelektrischen Punkt. An diesem Punkt liegt die Aminosäure hauptsächlich als Zwitter-Ion vor.
Isoelektrischer Punkt
Liegt der isoelektrische Punkt im Bereich zwischen dem pH-Wert 5 bis 6,5, so klassifiziert man die Aminosäure als eine neutrale Aminosäure. Liegt der isoelektrische Punkt unter dem pH-Wert 5, so spricht man von einer sauren Aminosäure, liegt er über 6,5, so handelt es sich um eine basische Aminosäure.
Da beim isoelektrischen Punkt gleich viele negative und positive Ladungen existieren, können die Moleküle in einem durch Gleichspannung erzeugten elektrischen Feld nicht zu einer Elektrode wandern. Verändert man nun aber den pH-Wert einer Aminosäure-Lösung, dann verändert sich auch das chemische Gleichgewicht. Säuert man die Lösung z.B. an, dann ist der isoelektrische Punkt größer als der pH-Wert der Lösung und die Aminosäure nimmt ein Proton auf. Dadurch wird die Aminosäure zu einem Kation und wandert im elektrischen Feld zur Kathode (Minus-Pol).
Auf diese Art kann man ein Aminosäure-Gemisch trennen. Die Methode nennt man Elektrophorese.