Elektronenkonfiguration des Kohlenstoff-Atoms im Überblick
Organische Verbindungen sind Verbindungen, in denen wir vorwiegend Bindungen von Kohlenstoff-Atomen finden. In diesen Verbindungen besitzt der Kohlenstoff typische Elektronenkonfigurationen, die im Folgenden erklärt werden.
|
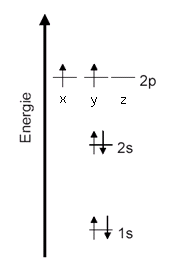
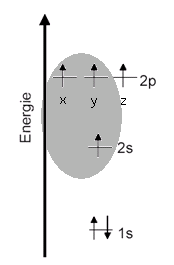
Grundzustand Diese Elektronenkonfiguration spiegelt den energetisch günstigsten wider. Diesen Zustand kann ein Kohlenstoff-Atom nur einnehmen, wenn es ganz alleine im Universum wäre. Sobald ein weiteres Atom in der Nähe ist, wäre die Edelgaskonfiguration der energetisch günstigste Zustand [1]. Die Edelgaskonfiguration wird durch gemeinsame Benutzung von Elektronen bzw. durch Überlappung von zwei Orbitalen, die jeweils nur mit einem Elektron belegt sind, erreicht. ------------------- [1] Universität Bayreutth, Didaktik der Chemie, http://daten.didaktikchemie.uni-bayreuth.de/ab_virtuell/pauling/p1_grundzust.htm , am 9.10.15 abgerufen |
Termschema (Energiestufenschema)
|
Orbital-Modell p-Orbitale sind hantelförmig (keulenförmig, sanduhrförmig). Es gibt also in einem p-Orbital zwei Bereiche großer Aufenthaltswahrscheinlichkeit für maximal 2 Elektronen. Diese Bereiche sind durch eine Knotenebene getrennt, die durch den Atomkern verläuft (Darstellung eines p-Orbitales). s-Orbitale drücken die kugelförmige Verteilung der Elektronendichte aus. Das 1s-Orbital liegt innerhalb des 2s-Orbitals und ist daher hier nicht sichtbar. Hinweis zur Form der Orbitale |
|
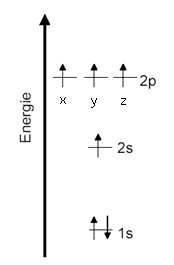
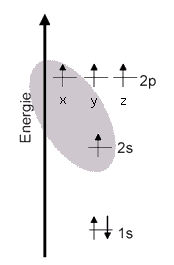
Angeregter Zustand In Verbindungen und in den Modifikationen des Kohlenstoffs (Graphit, Diamant, Fullerene) ist ein Kohlenstoff-Atom (in der Regel) vierbindig. Vier Bindungen kann ein Kohlenstoff-Atom allerdings nur eingehen, wenn es vier Orbitale besitzt, die jeweils nur mit einem Elektron halb besetzt sind.
|
Termschema Unter Berücksichtigung der Hundschen Regel kann man sich vorstellen, dass durch Energiezufuhr ein Elektron aus dem 2s-Orbital auf das höhere p-Orbital angehoben wird. Jetzt hätte ein Kohlenstoff-Atom vier halb besetzte Orbitale - allerdings auf unterschiedlichen Niveaus.
|
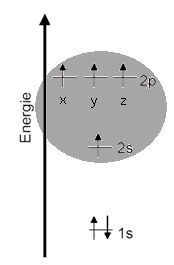
Orbital-Modell Man sieht hier sehr deutlich, dass das eine Elektron im 2s-Orbital wohl kaum eine Bindung mit einem anderen Atom eingehen kann. Dafür ist das Orbital für eine Überlappung mit einem anderen einfach besetzen Orbital eines anderen Atoms sehr unzugänglich. Alle Untersuchen sprechen dafür, dass ein Kohlenstoff-Atom - wenn es vier Einfachbindungen eingeht - immer vier gleichwertige Bindungen aufbaut. |
|
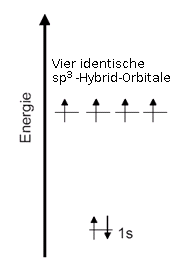
sp3-Hybridisierung Die vier einfach besetzten Orbitale des angeregten Zustandes können einen energetisch günstigeren Zustand erreichen, wenn sie sich alle miteinander mischen.
|
Termschema Die entstehenden vier völlig identischen Orbitale heißen Hybrid-Orbitale, da sie durch Mischung zustande gekommen sind. Da für die Mischung ein s-Orbital und drei p-Orbitale benutzt wurden, heißen diese Hybrid-Orbitale sp3-Hybrid-Orbitale.
|
Orbital-Modell Die zur Bindung fähigen vier identischen sp3-Hybrid-Orbitale nehmen einen Tetraeder-Winkel von 109,5° ein. Die Orbitale - und damit auch die Elektronen - haben den größt möglichsten Abstand zueinander (=> Gillespie).
|
|
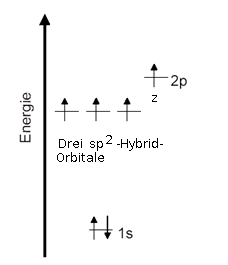
sp2-Hybridisierung
|
Termschema |
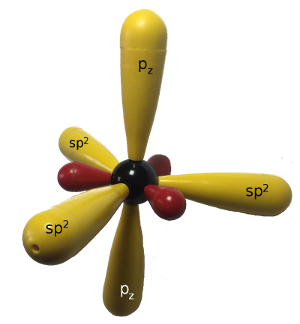
Orbital-Modell Beim sp2-hybridisierten Kohlenstoff-Atom liegen die drei sp2-Hybrid-Orbitale in einer Ebene und bilden zueinander einen 120°-Winkel. Das pz-Orbital steht senkrecht zu dieser Ebene. |
|
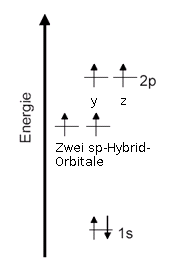
sp-Hybridisierung
|
Termschema
|
Orbital-Modell
|
 In seinen Verbindungen und in seinen Modifikationen (Graphit, Diamant, Fullerene) können die Kohlenstoff-Atome folgende Elektronenkonfigurationen besitzen:
In seinen Verbindungen und in seinen Modifikationen (Graphit, Diamant, Fullerene) können die Kohlenstoff-Atome folgende Elektronenkonfigurationen besitzen:
- Vier sp3-Hybrid-Orbitale
- Drei sp2-Hybrid-Orbitale und ein p-Orbital
- Zwei sp-Hybrid-Orbitale und zwei p-Orbitale (=> Ausbildung von Dreifachbindungen)