Aufstellen von Mesomerieformeln
Warum man Mesomerieformeln aufstellt, haben Sie schon beim Thema Mesomerie am Beispiel von 1,3-Butadien erfahren. Dort findet man auch die Definition und die theoretischen Hintergründe sowie die Anwendungsbereiche.
Nicht alle Mesomerieformeln, die man für eine Strukturformel eines Mokeküls theoretisch finden kann, sind nahe an der wahren Struktur des Moleküls. Einige sind aus energetischen Gründen so unwahrscheinlich, dass es sinnvoll ist, Regeln zu kennen, um nur die wichtigsten Mesomerieformeln (also die energieärmeren) betrachten zu können.
Regel 1
- Es werden immer die Mesomerieformeln bevorzugt, bei denen für alle am Molekül beteiligten Atome die Oktettregel erfüllt ist.
- Je mehr Elektronenpaarbindungen vorhanden sind, desto stabiler (energieärmer) ist die Grenzformel.
Regel 2
Negative Ladungen sollten bevorzugt am Atom mit der größten Elektronegativität lokalisiert sein. Positive Ladungen sollten am Atom mit der geringsten Elektronegativität lokolaisiert sein. Die Mesomerieformel, bei der die entgegen gesetzten Ladungen näher beieinander sind, ist die stabilere, also energieärmere Grenzformel.
Regel 3
Neutrale Mesomerieformeln sind Mesomerieformeln mit Ladungen vorzuziehen. Bei Mesomerieformeln mit Ladungen gilt: Die Grenzform ist umso stabiler, je weniger Ladungen sie hat.
Regel 4
Um Regel 1 nicht zu verletzten, sind manchmal Ladungen beim Aufstellen von Mesomerieformeln nicht zu vermeiden.
Beispiele:
 Alle drei Resonanzformeln des Carbonat-Ions sind gleichwertig. Jedoch stellt keines der Formeln eine ausreichende Beschreibung des Moleküls dar.
Alle drei Resonanzformeln des Carbonat-Ions sind gleichwertig. Jedoch stellt keines der Formeln eine ausreichende Beschreibung des Moleküls dar.
Die Wahrheit liegt sozusagen in der Mitte:
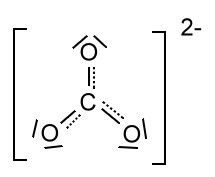 Die negative Ladung ist über die drei Sauerstoff-Atome gleichmäßig verteilt (delokalisiert). Dementsprechend findet man auch für dieses symmetrische Molekül eine trigonale Form, bei der alle Bindungslängen gleich sind.
Die negative Ladung ist über die drei Sauerstoff-Atome gleichmäßig verteilt (delokalisiert). Dementsprechend findet man auch für dieses symmetrische Molekül eine trigonale Form, bei der alle Bindungslängen gleich sind.
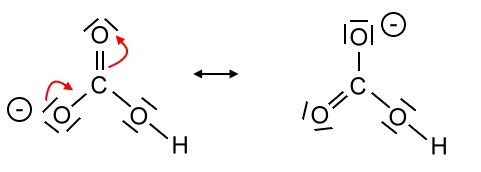
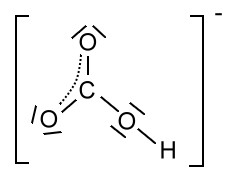
Beim Hydrogencarbonat-Ion ergeben sich nur zwei sinnvolle Resonanzformeln:
Auch hier ist folgende Formel mit der delokalisierten Ladung die wahrscheinlichere:
Da man für das Carbonat-Ion eine mesomere Formel mehr aufstellen kann, kann man davon ausgehen, dass das Carbonat-Ion gegenüber dem Hydrogencarbonat-Ion stabiler ist. Dies steht auch im Einklang mit dem natürlichen Kalkkreislauf.
--------------------------------------------
Quelle: K.P.C. Vollhardt, N.E. Schorre, Organische Chemie, 3. Auflage, Wiley-VCH, 2000, S. 28 ff.