Die Delokalisierung im Benzol
Benzol war schon einmal ein Thema in Basic 4.
Hier soll auf die Bindungsverhältnisse konkreter eingegangen werden.
Kekules postulierte im Jahre 1872 zwei gleichwertige Strukturen, die sich in der Lage der Doppelbindungen unterscheiden und durch "mechanische Bewegung" ineinander übergehen sollten. Heute würde man diese "mechanische Bewegung" eher dem Begriff Mesomerie zuordnen. Aufgrund dieser Strukturformel wäre die systematische Bezeichnung dieses Stoffes "Cyclohexatrien". Cyclo=Ring, hexa=Stammname für sechs Kohlenstoff-Atome, tri=drei, en=Doppelbindungen.
Das Benzol-Molekül müsste wegen der unterschiedlichen Bindungslängen von C-C-Einfach- und C=C-Zweifachbindungen die Gestalt eines unregelmäßigen Sechsecks geben. Röntgenografische Untersuchungen ergaben aber als Struktur ein ebenes, regelmäßiges Sechseck mit einheitlichen Bindungslängen und Bindungswinkeln. Alle C/C-Bindungen im Benzolmolekül müssen daher völlig gleichartig sein.
Es schien unmöglich, mit der klassischen Valenzstrichschreibweise den Bindungszustand im Benzol richtig wiederzugeben. Erst viel später konnte man mit Hilfe der Orbitaltheorie die Bindungsverhältnisse im Benzol-Molekül klären:
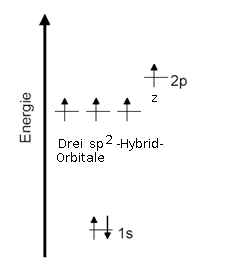
Die Kohlenstoff-Atome besitzen im Benzol-Molekül drei sp2-Hybridorbitale und ein p-Orbital. Jedes dieser Orbitale ist mit einem Elektron besetzt, weshalb auch ein solches Kohlenstoff-Atom vier Bindungen eingehen kann: Die drei sp2-Hybridorbitale bilden zwei σ-Bindung (sigma-Bindungen) zu den benachtbarten Kohlenstoff-Atomen und eine σ-Bindung zum Wasserstoff-Atom. Das p-Orbital kombiniert mit einem p-Orbital eines benachtbarten Kohlenstoff-Atoms zu einer π-Bindung (pi-Bindung). Diese ergibt mit der einen σ-Bindung die Doppelbindung beim Cyclohexatrien. Vergleiche auch die Doppelbindung beim Ethen.
In der Skelettstrukturformelschreibweise lässt man die Wasserstoff-Atome weg. In den Ecken des Sechsrings befinden sich die Kohlenstoff-Atome. Da Kohlenstoff vierbindig ist, kann man schlussfolgern, dass an jeder Ecken noch eine Bindung zu einem Wasserstoff-Atom sein muss.
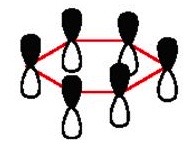
Schauen wir uns noch einmal nur die σ-Bindungen zwischen den Kohlenstoff-Atomen an. Alle sechs σ-Bindungen sind durch lineare Kombination von sp2-Hybrid-Atomorbitalen der sechs Kohlenstoff-Atome entstanden.
Die p-Atomorbitale kombinieren nicht nur mit einem benachtbarten p-Atomorbital, sondern mit beiden benachtbarten p-Atomorbitalen. Dieses Phänomen hatte wir schon bei der Betrachtung von 1,3-Butadien diskutiert.
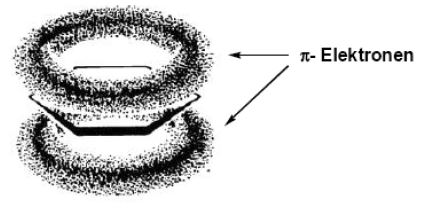
Es entsteht also ein delokalisiertes π-Elektronensystem, welches sich über das ganze Molekül ausstreckt. die Elektronen, die sich in diesem System befinden werden auch π-Elektronen genannt. Sie können sich über das ganze System "bewegen".
π-Bindungen sind im Gegensatz zu den σ-Bindungen nicht frei drehbar. Wir hatten das schon beim Ethen festgestellt. Damit wird klar, warum es sich beim Benzol um ein planares Molekül handelt. Wir haben hier also wieder ein Beispiel dafür, dass das Orbitalmodell bei der Betrachtung von Molekülgeometrien gegenüber des Bohrschen Atommodells das bevorzugte Modell sein sollte.
Aufgrund der geschilderten Betrachtungen wird heute die Strukurformel folgendermaßen geschrieben: