Das Stoffteilchenmodell erklärt physikalische Eigenschaften
Bewegung von Stofftteilchen
Das Stoffteilchenmodell erklärt vor allem die Aggregatzustände und deren Übergänge, also Zustandsänderungen, keine chemischen Umwandlungen (chemische Reaktionen).
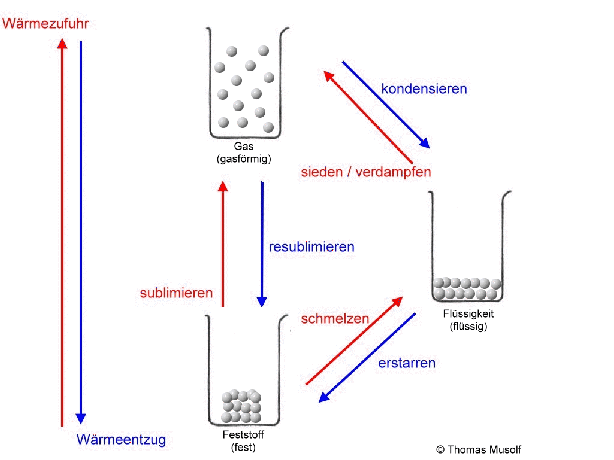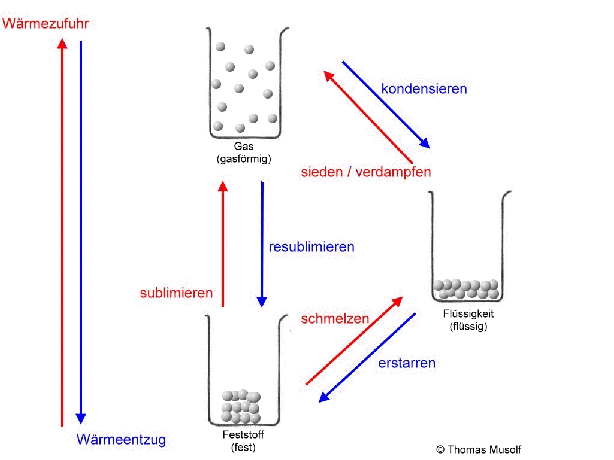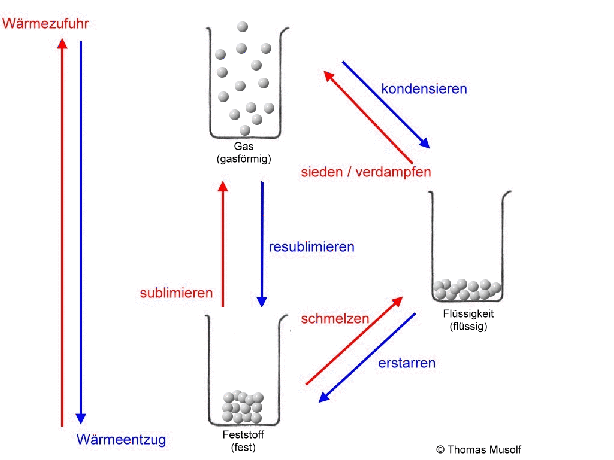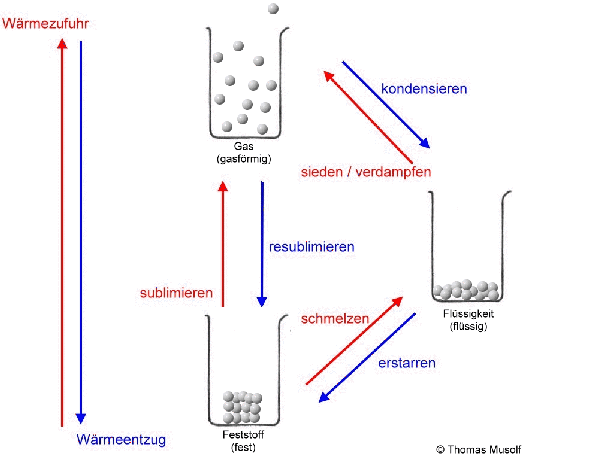

Bei einer theoretischen Temperatur von -273,15 °C (= 0 Kelvin) bewegen sich Stoffteilchen überhaupt nicht.
Mit zunehmender Temperatur nehmen Stoffteilchen immer mehr Wärmeenergie auf und wandeln sie in Bewegungsenergie um.
Stellen wir uns einen Stoff vor, der bei Raumtemperatur einen festen Aggregatzustand besitzt. Die Stoffteilchen haben bei Raumtemperatur so viel Bewegungsenergie aufgenommen, dass sie sich gegenseitig anstoßen. Da sie sich aber gegenseitig sehr stark anziehen, können sie ihre festen Plätze nicht verlassen. Man könnte sagen: Sie "zittern" bzw. „zappeln“ an ihrem Platz herum. Das machen dann alle Stoffteilchen mehr oder weniger gleich stark. Die Stoffteilchen bleiben aber auf ihren festen Plätzen. Feststoffe behalten ihre Form.
Erhitzt man diesen Feststoff, so „zappeln“ die Stoffteilchen immer heftiger. Dabei stoßen sie sich immer heftiger an. Das führt dazu, dass sich die Stoffteilchen etwas weiter voneinander entfernen. Die Stoffteilchen brauchen bei ihrem „Zappeln“ mehr Platz. So dehnen sich die meisten Feststoffe beim Erhitzen aus. Dies ist übrigens auch bei Flüssigkeiten und Gasen der Fall.
Wenn man einen Feststoff immer weiter erhitzt, dann schmilzt er irgendwann. Es sei denn, er zersetzt sich vorher. Aber von diesem Fall wollen wir an dieser Stelle nicht ausgehen. Beim Schmelzvorgang „zappeln“ einige Stoffteilchen so heftig, dass sie sich nicht mehr so gut „festhalten“ können, so dass sie sich verschieben oder aneinander vorbeigleiten. Schließlich „zappeln“ alle Stoffteilchen so stark, dass sich keines mehr richtig „festhalten“ kann: Der Stoff ist in den flüssigen Aggregatzustand übergegangen. Flüssigkeiten passen sich der Form des Behälters an, Flüssigkeiten kann man gießen.
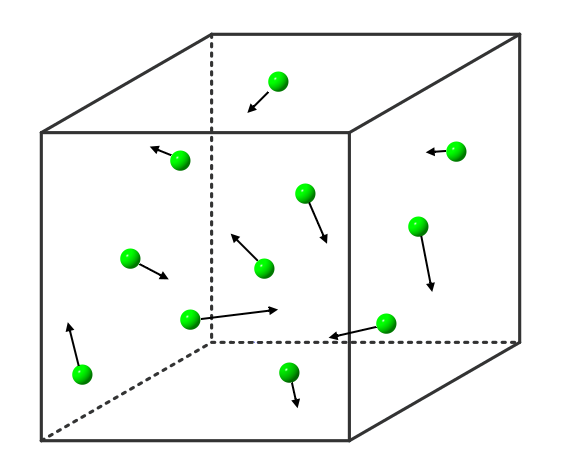 Wird die Flüssigkeit weiter erhitzt, so bewegen sich immer mehr Stoffteilchen so heftig, dass sie sich gar nicht mehr gegenseitig festhalten können: Immer mehr Stoffteilchen verlassen den Stoffteilchenverband und damit die flüssige Phase. Sie gehen in den gasförmigen Zustand über. Dort bewegen sie sich mit großer Geschwindigkeit, treffen auf andere Stoffteilchen, übertragen hierbei Energie und bewegen sich, wie Billardkugeln die zusammengestoßen sind, in einer anderen Richtung weiter. Die Stoffteilchen bewegen sich also ungeordnet in alle Richtungen. Die Stoffteilchen im gasförmigen Zustand bewegen sich auch nicht alle gleich schnell. Einige sind etwas schneller, einige etwas langsamer (das soll durch die Länge der Pfeile in der Abbildung verdeutlicht werden).
Wird die Flüssigkeit weiter erhitzt, so bewegen sich immer mehr Stoffteilchen so heftig, dass sie sich gar nicht mehr gegenseitig festhalten können: Immer mehr Stoffteilchen verlassen den Stoffteilchenverband und damit die flüssige Phase. Sie gehen in den gasförmigen Zustand über. Dort bewegen sie sich mit großer Geschwindigkeit, treffen auf andere Stoffteilchen, übertragen hierbei Energie und bewegen sich, wie Billardkugeln die zusammengestoßen sind, in einer anderen Richtung weiter. Die Stoffteilchen bewegen sich also ungeordnet in alle Richtungen. Die Stoffteilchen im gasförmigen Zustand bewegen sich auch nicht alle gleich schnell. Einige sind etwas schneller, einige etwas langsamer (das soll durch die Länge der Pfeile in der Abbildung verdeutlicht werden).
Man muss sich vorstellen, dass um uns herum unvorstellbar viele, extrem winzige Stoffteilchen mit enormer Geschwindigkeit fliegen, die nach extrem kurzer Strecke aufeinanderprallen und natürlich auch auf uns prallen. Dieser Umstand erklärt die Umgebungstemperatur, da die Stoffteilchen beim Zusammenprall ein Teil ihrer Bewegungsenergie an uns oder andere Gegenstände abgeben.
Beim Abkühlen eines Gases sinkt die mittlere Geschwindigkeit der Stoffteilchen. Sind die Stoffteilchen langsam genug, so können sie sich gegenseitig anziehen. Bei -195,8 °C haben Stickstoff-Moleküle eine mittlere Geschwindigkeit von rund 870 km/h. Diese Geschwindigkeit reicht aus, dass die Stickstoff-Moleküle sich gegenseitig „festhalten“ können: Stickstoff liegt dann im flüssigen Aggregatzustand vor.
Schmelz- und Siedepunkte sind typische Eigenschaften von Reinstoffen.
 Reines Wasser siedet immer bei 100°C (bei Normaldruck)! Für jeden Stoff gibt es eine exakte Siede- bzw. Schmelztemperatur, die man messen kann. Bei unbekannten Stoffen kann man auf diese Weise herausbekommen, um welchen Stoff es sich handelt, wenn man entsprechende Tabellen hat.
Reines Wasser siedet immer bei 100°C (bei Normaldruck)! Für jeden Stoff gibt es eine exakte Siede- bzw. Schmelztemperatur, die man messen kann. Bei unbekannten Stoffen kann man auf diese Weise herausbekommen, um welchen Stoff es sich handelt, wenn man entsprechende Tabellen hat.
Eine sehr gute Animation zu den Aggregatzuständen zeigt www.chemie-interaktiv.net







