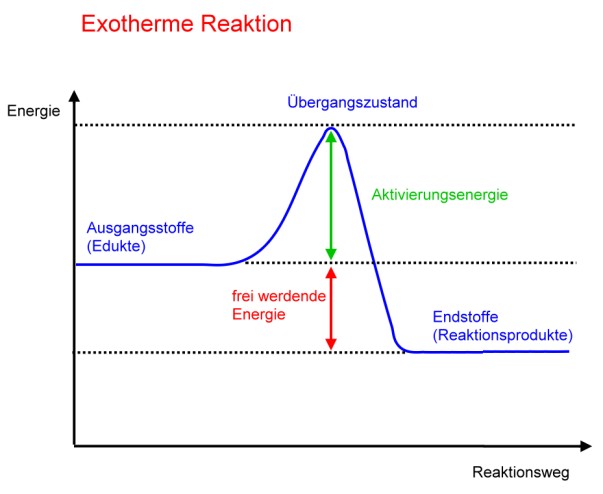
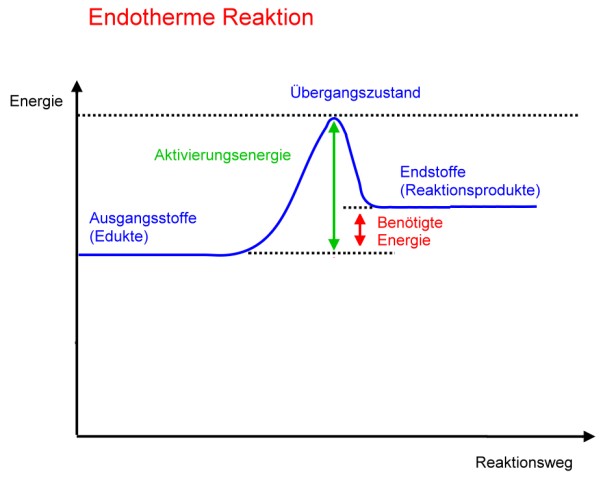
Aktivierungsenergie
Die meisten Reaktionen benötigen zunächst eine Energie, damit die Reaktion überhaupt abläuft. Manche Stoffe muss man anzünden oder erhitzen. Bei anderen genügt ein Funke. Diese zunächst den Stoffen zugefügte Energie nennt man AktivierungsenergieLex. Wird anschließend bei der Reaktion mehr Energie frei, als man anfangs zugefügt hat, so spricht man von einer exothermen Reaktion; wird weniger Energie frei, so spricht man von einer endothermen Reaktion.
Eine exotherme Reaktion ist also eine Reaktion, bei der die Aktivierungsenergie kleiner ist als die frei werdende Energie.
Bei einer endothermen Reaktion ist die Aktivierungsenergie größer als die Energie, die bei der Reaktion anschließend frei wird.
Bei der Entscheidung, ob eine Reaktion exotherm oder endotherm ist, geht es also um eine Bilanz.