Synthese und Analyse des Wasserstoffs
Wasserstoff ist das leichteste ElementLex im Universum. Das Elementsymbol ist H. Wasserstoff kommt als Stoff molekularLex vor.
Wasserstoff verbrennt an der Luft mit blauer Flamme.
Wasserstoff kommt praktisch nicht in unserer Luft vor, da er beim Entstehen durch die Atmosphäre ins Weltall gelangt. Man kann ihn herstellen (synthetisieren), indem man ein unedles Metall, wie z.B. Zink, mit Salzsäure reagieren lässt.
Den aufgefangenen Wasserstoff kann man mit Hilfe der Knallgasprobe nachweisen.
Bei der Knallgasprobe reagiert der Wasserstoff mit dem Luftsauerstoff. Die hierbei frei werdende Energie äußert sich unter anderem durch ein hörbares Geräusch.
Die Knallgasprobe ist eine Nachweisprobe für Wasserstoff. Wenn man auf diese Weise Wasserstoff nachweisen kann, sagt der Chemiker: "Die Knallgasprobe ist positiv verlaufen".
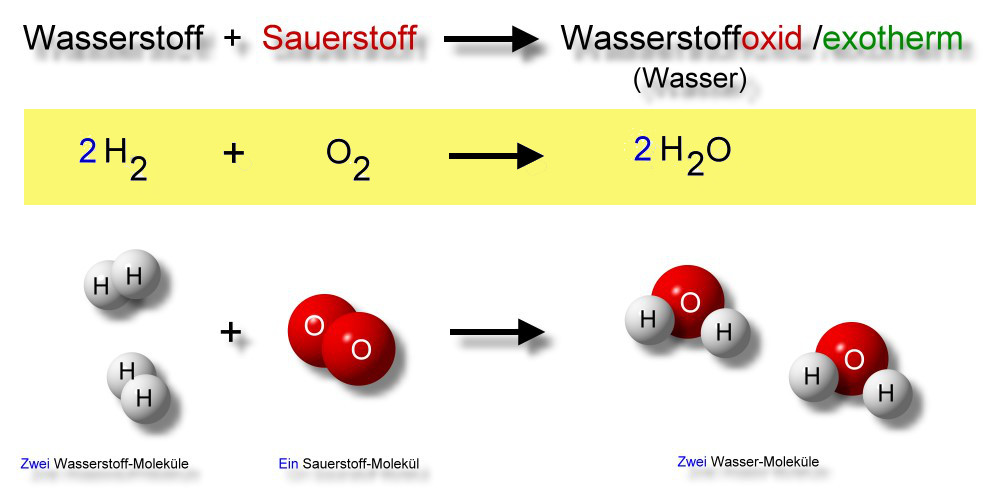
Wortreaktionsschema
Wasserstoff + Sauerstoff → Wasserstoffoxid (Wasser) / exotherm
Mit der Knallgasprobe kann man nicht nur den Wasserstoff nachweisen. Sie macht auch deutlich, dass Wasser eine Verbindung aus den Elementen Wasserstoff und Sauerstoff ist.
Bei der Knallgasprobe im Reagenzglas macht man folgende Beobachtungen:
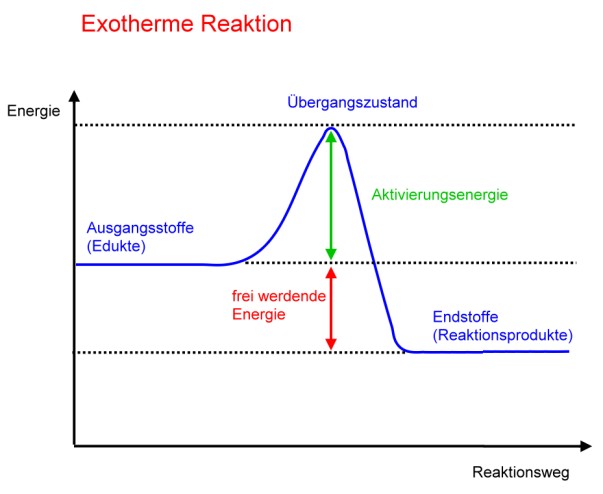
- Man hört ein pfeifendes Geräusch => Energie wird frei (kleine Explosion) => Es hat eine exotherme Reaktion stattgefunden.
- Das Reagenzglas wird warm => Energie wird frei (Wärme) => Es hat eine exotherme Reaktion stattgefunden.
- Eine blaue Flamme zischt in das Reagenzglas hinein => Wasserstoff brennt - bevor er dann mit dem Luftsauerstoff reagiert - mit blauer Flamme => Wasserstoff ist brennbar.
- Das Reagenzglas beschlägt im Inneren. Es entsteht eine farblose Flüssigkeit => Ein neuer Stoff mit neuen Eigenschaften ist entstanden. Es hat also eine chemische Reaktion stattgefunden.
Zusammenfassung
- Synthese von Wasserstoff durch die Reaktion von Salzsäure mit einem unedlen Metall.
- Nachweis von Wasserstoff mit der Knallgasprobe. Hierbei wird auch Wasser synthetisiert.






 Da bei der Knallgasreaktion viel Energie frei wird und keine umweltschädlichen Stoffe entstehen, versucht man heute durch eine kontrollierte Verbrennung des Wasserstoffs (Brennstoffzelle) Kraftfahrzeuge anzutreiben.
Da bei der Knallgasreaktion viel Energie frei wird und keine umweltschädlichen Stoffe entstehen, versucht man heute durch eine kontrollierte Verbrennung des Wasserstoffs (Brennstoffzelle) Kraftfahrzeuge anzutreiben.
 Auch in der Raketentechnik wurde Wasserstoff in Kombination mit Sauerstoff (beide in flüssigem Aggregatzustand) als Treibstoff verwendet. Die Saturn V, die für die Mondlandung eingesetzt worden ist, wurde mit diesem Treibstoffgemisch betrieben. Sie war eine der stärksten Raketen, die jemals gebaut wurden.
Auch in der Raketentechnik wurde Wasserstoff in Kombination mit Sauerstoff (beide in flüssigem Aggregatzustand) als Treibstoff verwendet. Die Saturn V, die für die Mondlandung eingesetzt worden ist, wurde mit diesem Treibstoffgemisch betrieben. Sie war eine der stärksten Raketen, die jemals gebaut wurden.





