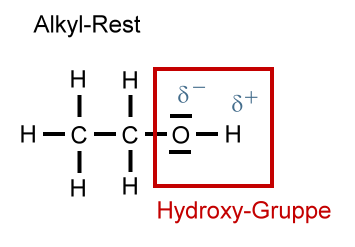Hydroxy-Gruppe im Detail
Die typischen Eigenschaften der Alkanole (Alkohole) liegen in der funktionellen Gruppe der Alkohole begründet.
Die funktionelle Gruppe der Alkanole heißt Hydroxy-Gruppe (oder einfach nur OH-Gruppe), früher auch Hydroxyl-Gruppe genannt.
Mit dem Struktomat gezeichnet (einschließlich der nicht bindenden Elektronenpaare)
Polare Hydroxy-Gruppe
Die Hydroxy-Gruppe ist eine polare Gruppe; sie besitzt eine polare Atombindung. Das Sauerstoff-Atom besitzt eine negative Teilladung (Partialladung, δ-), das Wasserstoff-Atom eine positive Teilladung (Partialladung, δ+). Aufgrund der polaren Hydroxy-Gruppe können sich die Moleküle untereinander mit Hilfe von "Wasserstoffbrücken" anziehen. Die "Wasserstoffbrücken" sind erheblich stärker als die van-der-Waals-Kräfte.
Wie kommt die Polarität zustande?
Jede Atomart, also jedes Atom eines unterschiedlichen Elementes, hat ein unterschiedliches Bestreben die Bindungselektronen anzuziehen. Dieses Bestreben nennt man Elektronegativität [E]. Ist die Elektronegativität der Bindungspartner gleich oder beträgt die Elektronegativitätsdifferenz [ΔE] < 0,5, so liegt eine einfache Atombindung (kovalente Bindung, Elektronenpaarbindung) vor. Ab Werten zwischen 0,5 bis ca. 2 1) werden die Bindungselektronen, und damit negative Ladungen, jedoch so weit verschoben, dass dieser Bereich des Moleküls wirksame Teilladungen besitzt. Die Bindungselektronen werden zu dem Atom verschoben, das die größere Elektronegativität besitzt. Die Folge ist eine polare Atombindung. Die an dieser Bindung beteiligten Atome besitzen Teilladungen (Partialladung: - oder +). Ist die Elektronegativitätsdifferenz größer als ca. 2, so kann unter bestimmten Umständen das Bindungs-Atom mit der größeren Elektronegativität dem anderen Atom das Bindungselektron (bzw. die Bindungselektronen) entreißen: Es entstehen Ionen.
1) [Anmerkung: Die Werte der Elektronegativitäten und die Einteilung, ab welcher Elektronegativitätsdifferenz eine Ionisierung stattfindet, sind in der Literatur unterschiedlich. Man darf nicht vergessen, dass es keine scharfe Grenze einer Einteilung gibt. Oft wird der Wert in der Literatur mit 1,7 oder 1,8 statt hier mit 2 angegeben.]
Die Elektronegativitätsdifferenz in der Hydroxy-Gruppe beträgt (nach Pauling): [ΔE] = 3,4-2,2 = 1,2. Die Hydroxy-Gruppe besitzt also eine polare Atombindung und somit ist die Hydroxy-Gruppe selbst polar.