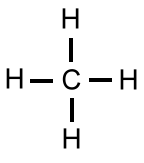
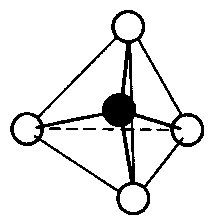
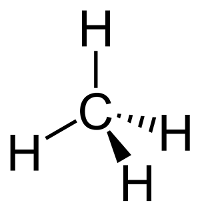
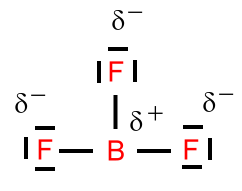Das LEWIS-Konzept unter Berücksichtigung der Mesomerie
Die Lewis-Formeln (auch bekannt als Strukturformeln oder Valenzstrichformeln)
Lewis-Formeln begegnen uns häufig in der Chemie. Dieser Artikel setzt folgendes Vorwissen voraus:
In diesem Artikel widmen wir uns der Erstellung von Lewis-Formeln für komplexere Moleküle und untersuchen einige besondere Fälle.

Einführung in die Lewis-Formeln
LEWIS-Formeln beschreiben die Bindungsverhältnisse in Molekülen oder Anionen. Das von Gilbert N. LEWIS 1916 entwickelte Konzept geht davon aus, dass Bindung zwischen Atomen eines Moleküls durch die gemeinsame Nutzung von Elektronen entstehen.
- Bindende Elektronenpaare werden durch Striche dargestellt. Sie entstehen aus ungepaarten Valenzelektronen der beteiligten Atome und bilden kovalente Bindungen (auch Elektronenpaarbindungen oder Atombindungen genannt).
- Nichtbindende Elektronenpaare (freie Elektronenpaare) werden ebenfalls als Striche gezeigt, um die Oktettregel überprüfen zu können. Diese Elektronen tragen nicht zu einer Bindung bei.
Hinweis: Bei der Erstellung von Lewis-Formeln wird ausschließlich mit Valenzelektronen gearbeitet.
Regeln der LEWIS-FORMELN - mit Beispielen
Regel 1: Wertigkeiten und die Oktettregel
Die Nichtmetall-Atome müssen den im Periodensystem der Elemente (PSE) angegebenen Wertigkeiten (alt: Bindigkeiten. Viel besser: Oxidationsstufen) entsprechen, wobei die im PSE von Chemiezauber.de unterstrichenen Wertigkeiten bevorzugt werden.
Die Oktettregel (8 Elektronen = voll besetzte Valenzschale) gilt streng genommen nur für die Hauptgruppen-Elemente der 2. und 3. Periode. Sie besagt, dass die Atome bestrebt sind, eine voll besetzte äußerste Schale (Valenzschale), also eine Edelgaskonfiguration, zu erreichen.
In der 1. Periode spielen nur die Wasserstoff-Atome ein Rolle, die immer 1-wertig sind. Wasserstoff ist also bezüglich der Oktett-Regel eine Ausnahme, da die Schale des Wasserstoff-Atoms nur bis zu zwei Elektronen aufgefüllt werden kann.
Besonderheiten
Regel 2: Mehrfachbindungen und die Oktettregel
Bei einigen Molekülen erfordert die Einhaltung der Oktettregel die Bildung von Doppel- oder Dreifachbindungen.
Regel 3: Elemente der 5. Hauptgruppe
Die Elemente der 5. Hauptgruppe besitzen eine ungerade Anzahl an Valenzelektronen (z.B. Stickstoff!). Die Einhaltung der Oktettregel ist hier manchmal nicht möglich. Es entstehen Radikale, die in der Regel sich untereinander binden (Dimerisierung).
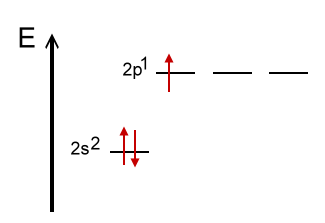
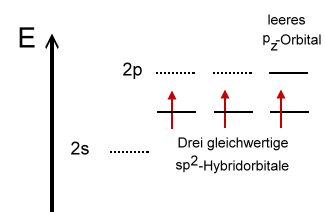
Regel 4: Schwefel und Phosphor (Elemente der 3. Periode)
Die beiden Nichtmetall-Elemente Phosphor und Schwefel stehen in der 3. Periode. Hier lässt sich die Oktettregel durch die Verwendung von mesomeren Grenzstrukturformeln aufrecht erhalten.
 Mesomerie (Resonanz) beschreibt denZustand, indem sich Elektronen in einem Bindungssystem nicht bestimmten Bindungen zuordnen lassen. Sie sind über einen Bereich des Moleküls delokalisiert. Dies wird durch Grenzstrukturformeln beschrieben, bei der oft formale Ladungen vorliegen. Formalladungen werden, im Gegensatz zu Ionenladungen, in einem Kreis gezeichnet.
Mesomerie (Resonanz) beschreibt denZustand, indem sich Elektronen in einem Bindungssystem nicht bestimmten Bindungen zuordnen lassen. Sie sind über einen Bereich des Moleküls delokalisiert. Dies wird durch Grenzstrukturformeln beschrieben, bei der oft formale Ladungen vorliegen. Formalladungen werden, im Gegensatz zu Ionenladungen, in einem Kreis gezeichnet.
Moleküle mit mesomeren Grenzformeln sind stabiler, das die Elektronendelokalisation die Energie des Systems senkt.
Beispiel: Ozon-Molekül
Im Ozonmolekül besitzt jedes Sauerstoff-Atom eine unterschiedliche Wertigkeit (Bindigkeit). Um die Oktett-Regel zu erfüllen, muss nicht nur eine Doppelbindung aufgebaut werden, es entstehen sogar zwei formale Ladungen. Hierbei gibt es zwei verschiedene Möglichkeiten. Es sind Grenzfälle. Solche Formeln werden Grenzstrukturformeln genannt und mit dem abgebildeten Mesomeriepfeil versehen.
Das Ozon-Molekül ist gewinkelt (116,8°). Das nicht bindende Elektronenpaar des mittleren Sauerstoff-Atoms beansprucht etwas mehr Platz als die Bindungselektronen und drückt daher die beiden anderen Sauerstoff-Atome nach unten.
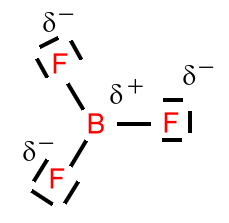
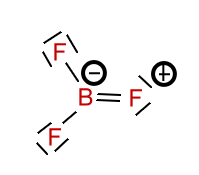
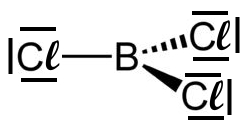
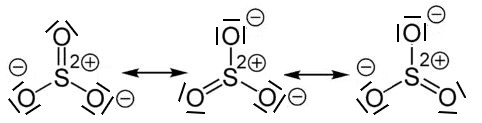
Beispiel: Schwefeltrioxid
Beim Schwefeltrioxid ist der BindungswinkelF-B-F = 120°. Das Molekül ist trigonal-planar gebaut. Die mesomeren Grenzstrukturformeln sind:
Anwendungsbeispiel: Das Carbonat-Ion
- Schreiben Sie zunächst die Summenformel des Teilchens auf.
- Ermitteln Sie nun die Anzahl an Elektronenpaaren und die Anzahl an Bindungen nach dem bekannten Muster.
- Nun bestimmt man das Zentralatom (das ist das Atom, das in der Summenformel nur ein Mal vorkommt und die meisten Bindungen aufbauen kann) und gruppiert die anderen Atome durch eine Einfachbindung jeweils im 90°-Winkel um das Zentralatom herum. Handelt es sich um ein Ion, so wird das Ganze von einer großen eckigen Klammer umgeben, die Ladung wird rechts hochgestellt notiert, wie bei Ionen üblich.
Sollten unter den anderen Atomen unterschiedliche Atome (z.B. Sauerstoff-Atome und Wasserstoff-Atome), so kommt man am häufigsten dann zum Erfolg, wenn man zunächst nur die Atomart mit der höchsten Bindigkeit an das Zentral-Atom bindet. - Die verbleibenden Bindungselektronen werden nun so eingebaut, dass das Zentral-Atom auf seine Bindigkeit kommt. Dann werden die restlichen Atome entsprechend ihrer Bindigkeit eingebaut.
- Zum Schluss werden die restlichen, nicht bindenden Elektronenpaare so verteilt, dass für jedes Atom die Edelgaskonfiguration erreicht ist.
- Gesamtlösung
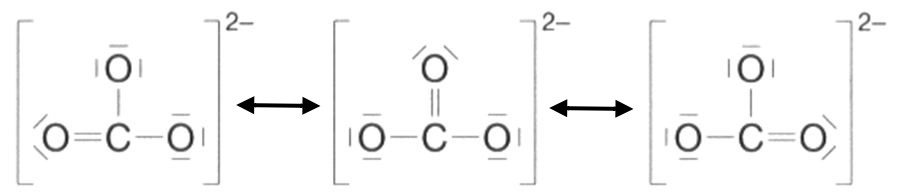
Es gibt also drei mesomere Grenzstrukturformeln für das Carbonat-Ion. Man kann sich diese mesomeren Grenzstrukturformeln auch durch "Umklappen" von Elektronenpaaren wie bei umfallenden Dominosteinen vorstellen:

Hier unter Berücksichtigung von GILLESPIE.
Folgende Darstellung soll die Delokalisierung der π-Elektronen verdeutlichen: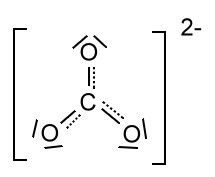
Mehr zum Thema Mesomerie