Eine Kraft zwischen den Wassermolekülen erklärt einige ungewöhnliche Eigenschaften des Wassers
Aufgrund der Tatsache, dass Wasser-Moleküle Dipolmoleküle sind (siehe: Struktur des Wassermoleküls im Schalenmodell), wirken zwischen den Molekülen Anziehungskräfte. Der Chemiker spricht auch in diesem Zusammenhang von Dipol-Dipol-Wechselwirkungen.
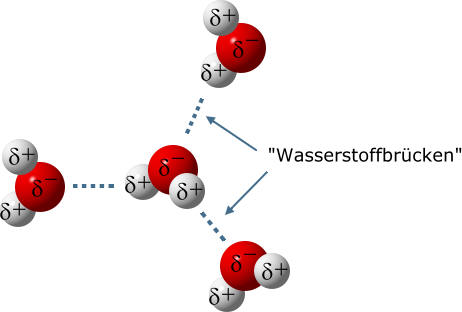
Wassermoleküle richten sich so aus, dass die Plus- und Minus-Teilladungen (Partialladungen) zueinander zeigen. Entgegengesetze Ladungen ziehen sich an!
 .Als "Wasserstoffbrücke" bezeichnet man eine Anziehungskraft zwischen einem stark polarisierten Wasserstoff-Atom und einem nichtbindenden Elektronenpaar eines (anderen) Moleküls. Sie wird am besten mit einer gepünkelten Linie gekennzeichnet, um sie klar von einer Atombindung zu unterscheiden. Eine "Wasserstoffbrücke" ist ein Sonderfall einer Dipol-Dipol-Wechselwirkungen.
.Als "Wasserstoffbrücke" bezeichnet man eine Anziehungskraft zwischen einem stark polarisierten Wasserstoff-Atom und einem nichtbindenden Elektronenpaar eines (anderen) Moleküls. Sie wird am besten mit einer gepünkelten Linie gekennzeichnet, um sie klar von einer Atombindung zu unterscheiden. Eine "Wasserstoffbrücke" ist ein Sonderfall einer Dipol-Dipol-Wechselwirkungen.
"Wasserstoffbrücken" sind weitaus schwächer als die Atombindungen innerhalb eines Moleküls. Allerdings kann ein Wasser-Molekül an mehreren Stellen eine "Wasserstoffbrücke" ausbilden. Der Einfluss der "Wasserstoffbrücken" ist also insgesamt betrachtet recht groß.
Achtung: Ein Lösen oder Bilden von "Wasserstoffbrücken" führt nicht zu einer chemischen Reaktion, also der Bildung von anderen Stoffen. Wenn jedoch Atombindungen gespalten werden, findet eine chemische Reaktion statt und es entstehen in der Folge neue Stoffe.
Man kann sich die Anziehungskräfte der "Wasserstoffbrücken" etwa so vorstellen, als wenn sich zwei Magnete, die man aneinander vorbei bewegt, anziehen würden. Je langsamer man diese Bewegung macht, umso besser wirkt die Anziehungskraft. Bei 0° C bewegen sich die Wasser-Moleküle so langsam, dass sie sich aufgrund der "Wasserstoffbrücken" tatsächlich festhalten können: Das Wasser gefriert zu festem Eis.
Die Folgen für die Eigenschaften des Wassers
Oberflächenspannung

Die Wassermoleküle haben also das Bestreben, sich in Form eines dreidimensionalen Netzes untereinander festzuhalten. Somit versucht Wasser seine Oberfläche möglichst klein zu halten.
Das erklärt auch die Kugelform von Wassertropfen und die Oberflächenspannung des Wassers.
Wasserläufer bei der Paarung. Bild von Markus Gayda, CC BY-SA 3.0, Link
Wasser ist flüssig
Die "Wasserstoffbrücken" erklären auch, warum Wasser trotz der geringen Molekülmasse bei Raumtemperatur flüssig und nicht gasförmig ist. Erst bei 100°C sind die Schwingungen der Wassermoleküle so groß, dass sie sich voneinander lösen können und in den gasförmigen Zustand übergehen können (Siedetemperatur).
Der Lotus-Effekt
Der Lotus-Effekt. Lesetipp hierzu (externer Link): https://www.max-wissen.de/101851/lotoseffekt , am 19.03.17 aufgerufen
------------------------------------
[1] Quelle: Römpp USB Stick · 2008, ISBN: 978-3-13-149231-9