Wasser - Transportmittel in der Natur
Als polares Lösemittel (Wassermoleküle sind Dipol-Moleküle) vermag Wasser polare Stoffe bzw. Stoffe, die aus Ionen bestehen, zu lösen. Ein Grundsatz ist: Gleiches löst sich in Gleichem. Polare Stoffe lösen sich also in polaren Lösemitteln, unpolare Stoffe lösen sich in unpolaren Lösemitteln, wie z.B. Benzin. Wie kann man sich aber den Lösevorgang auf der Teilchenebene vorstellen?
Fall A: Lösevorgang von wasserlöslichen Salzen
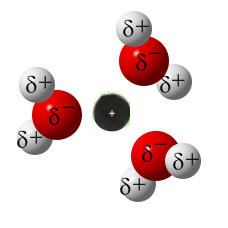
 Wassermoleküle können aufgrund ihres Dipol-Charakters einzelne Ionen aus dem Ionengitter des Salzes herausziehen und anschließend umhüllen. Die umhüllten Ionen können sich dann nicht mehr gegenseitig anziehen und verteilen sich im Lösemittel. Die einzelnen, umhüllten Ionen sind so winzig, dass man sie nicht mehr sehen kann. In diesem Zustand können sich die Ionen im Wasser bewegen. Erst wenn man das Wasser verdampft, entfällt die Umhüllung der Ionen, die sich dann wieder anziehen können. Wenn genug Ionen wieder zusammen sind, ist der Salzkristall so groß, dass wir ihn mit dem bloßen Augen wieder sehen können.
Wassermoleküle können aufgrund ihres Dipol-Charakters einzelne Ionen aus dem Ionengitter des Salzes herausziehen und anschließend umhüllen. Die umhüllten Ionen können sich dann nicht mehr gegenseitig anziehen und verteilen sich im Lösemittel. Die einzelnen, umhüllten Ionen sind so winzig, dass man sie nicht mehr sehen kann. In diesem Zustand können sich die Ionen im Wasser bewegen. Erst wenn man das Wasser verdampft, entfällt die Umhüllung der Ionen, die sich dann wieder anziehen können. Wenn genug Ionen wieder zusammen sind, ist der Salzkristall so groß, dass wir ihn mit dem bloßen Augen wieder sehen können.
Eine genaue Beschreibung des Vorganges findest du im nächsten Kapitel im Abschnitt "Der Lösevorgang eines Salzes in Wasser".
Bedeutung in der Natur
Das Lösen von Salzen bzw. Mineralien spielt in der Natur eine außerordentlich wichtige Rolle.
So nehmen Pflanzen eine Vielzahl von Mineralien in Form von den in Wasser gelösten Ionen über ihre Wurzeln auf. Diese sind wesentlich für ihr Wachstum und ihre Entwicklung.
So enthalten Pflanzendüngemittel Ionen wie Ammonium-Ionen (NH4+), Nitrat-Ionen (NO3-), Phosphat-Ionen (PO43-) und viele andere. Diese Ionen sind in verschiedenen Salzen wie Ammoniumnitrat (NH4+NO3-), Kaliumphosphat (K+3PO43-), Calciumnitrat (Ca2+(NO3-)2) und anderen enthalten.
Auch für Tiere und uns Menschen ist das "Universallösemittel" außerordentlich wichtig: Viele chemische Reaktionen und biochemische Prozesse, wie beispielsweise Enzymreaktionen, laufen nur mit Hilfe von Wasser in unserem Körper ab. Unser Blut besteht zu 92% aus Wasser, das wichtige Ionen in und aus den Zellen transportiert.
Fall B: Lösevorgang von polaren Flüssigkeiten
Es gibt polare Flüssigkeiten, wie z.B. Trinkalkohol (Ethanol), die in jedem Mischungsverhältnis in Wasser löslich sind, während unpolare Flüssigkeiten, wie Benzin, sich mit Wasser nicht mischen. Das kann man dann daran erkennen, dass die beiden Flüssigkeiten zwei Schichten bilden. Die Flüssigkeit mit der geringeren Dichte bleibt über der anderen Flüssigkeit.
Beim Schütteln mischen sich für kurze Zeit unpolare und polare Flüssigkeiten (Benzin/Wasser). Da die Wasser-Moleküle aufgrund ihrer "Wasserstoffbrücken" beieinander bleiben wollen, drängen sie die unpolaren "Benzin-Moleküle" weg, so dass letztendlich sich die beiden Flüssigkeiten trennen.
In einem Wasser-Ethanol-Gemisch (Lösung) sind die beiden unterschiedlichen Moleküle insofern ähnlich, als dass sie alle untereinander "Wasserstoffbrücken" ausbilden können.