Lehrerversuch!
Geräte und Chemikalien:
Kupfer(II)-chlorid-Lösung, Salzsäure, Aluminiumfolie
Erlenmeyerkolben (250-300 ml, Weithals).
Gefahren:
Salzsäure und Schwefelsäure sind ätzend, Kupfersalze sind giftig.
Keine brennbaren Stoffe in der Nähe des Experiments lagern.
Durchführung:
In einen Erlenmeyerkolben werden 100 ml Kupfer(II)-chlorid-Lösung (CuCl2-Lösung) der Stoffmengenkonzentration 1 mol/l und 50 ml konz. Salzsäure (HCl(l)) geben. In den Erlenmeyerkolben wird ein Stück geknüllte Alufolie geben.
Beobachtung:
In der salzsauren Kupferchlorid-Lösung tritt eine heftige Reaktion ein. Dabei entsteht ein Gas, das sich entzünden lässt und mit blaugrüner Flamme brennt. Die Lösung erhitzt sich stark, nach kurzer Zeit erlischt die Flamme. Im Kolben findet sich nach dem Abklingen der Reaktion metallisches Kupfer.
Erklärung:
(7./8. Klasse)
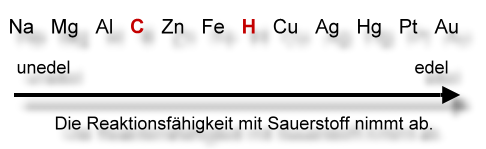
Aluminium ist ein sehr unedles Metall (siehe einfache Oxidationsreihe). An der Luft überzieht es sich - sogar ohne erhitzt zu werden - mit einer dichten Aluminiumoxidschicht, so dass es nicht weiter reagieren kann. In der salzsauren Salzlösung wird die Oxidschicht jedoch angegriffen. Sobald an einer Stelle die Aluminiumoberfläche frei ist, kann die Reaktion mit der Salzsäure stattfinden. Dabei entsteht aus dem Salz Kupfer und aus der Salzsäure Wasserstoff. Wasserstoff ist brennbar. Die Flamme wird durch Kupfer blaugrün gefärbt. Die Reaktion ist stark exotherm: Es bildet sich Wasserdampf, der die Flamme erstickt.
(9. Klasse)
Aluminium ist ein sehr unedles Metall (siehe einfache Oxidationsreihe). An der Luft überzieht es sich - sogar ohne erhitzt zu werden - mit einer dichten Aluminiumoxidschicht, so dass es nicht weiter reagieren kann. Aluminiumoxid ist praktisch wasserunlöslich und auch gegen verdünnte Säuren und schwache Laugen beständig. Liegen jedoch Komplexbildner vor, hier sind dies die Chlorid-Ionen, kann die Oxidschicht leicht aufgelöst werden. Sobald an einer Stelle die Metalloberfläche frei liegt, kann daran eine Redox-Reaktion mit den Kupfer-Ionen einsetzen. Elementares Kupfer scheidet sich ab. Dabei bildet sich ein Lokalelement aus. An diesem erfolgt die intensive Reaktion des Aluminiums mit der Salzsäure, wobei Wasserstoff entsteht. Der Wasserstoff lässt sich entzünden. Die Flamme wird durch Kupfer blaugrün gefärbt. Die Reaktion ist stark exotherm: Es bildet sich Wasserdampf, der die Flamme erstickt.
Entsorgung:
Die neutralisierten Lösungen kommen zum Schwermetall-Abfall.
Literatur:
W. v. d. Veer, P. de Rijke, M. Oetken, W. Jansen: "Spektakuläre 'Vernichtung' von Aluminium"; PdN-Chemie, 49 (2000), 13
S. Nick, I. Parchmann, R. Demuth: "Chemisches Feuerwerk" - V. 45, S. 204-206