Exkurs: Das Aufstellen von Lewis-Formeln bei einfachen Molekülen unter Berücksichtigung des Elektronenpaarabstoßungs-Modells von GILLESPIE
Die Lewis-Formeln (Strukturformeln, Valenzstrichformeln) beschreiben Bindungsverhältnisse in Molekülen (oder Anionen). Das Bindungskonzept von LEWIS (1916 entwickelt) geht davon aus, dass die Bindung zwischen den Atomen eines Moleküls durch die gemeinsame Benutzung von Elektronen erfolgt. Auf diese Weise erhält jedes Atom im Molekül eine voll besetzte Valenzschale und damit die sogenannte Edelgaskonfiguration. Man nennt diese Bindungsart durch gemeinsame Benutzung von Bindungselektronen Elektronenpaarbindung, kovalente Bindung oder auch Atombindung. Die übrigen Elektronenpaare werden als nichtbindende oder freie Elektronenpaare bezeichnet. Wohl gemerkt: Es geht hier ausschließlich um Valenzelektronen. In Lewis-Formeln stellt man ein Bindungselektronenpaar durch einen Strich zwischen den entsprechenden Elementsymbolen dar.
Schauen wir uns zunächst einmal an, wie man die einzelnen Atome nach der Lewis-Formel schreiben kann, wobei wir nur die Nichtmetall-Atome betrachten, da nur diese Atombindungen eingehen:
Da die Hauptgruppenzahl im PSE die Anzahl an Valenzelektronen angibt, zeichnet man entsprechend so viele Punkte um das Elementsymbol herum. Wo man damit anfängt, ist egal. Stickstoff steht in der V. Hauptgruppe, besitzt also 5 Valenzelektronen. Wenn man z.B. mit der Setzung der Punkte oben anfängt, dann hat man oben zwei Punkte, also ein Elektronenpaar. Elektronenpaare werden als Striche gezeichnet. Man sieht hier schon, wieviel bindig die Atome sind. Ein Sauerstoff-Atom z.B. hat zwei einzelne Elektronen und wird daher (in der Regel) zwei Bindungen aufbauen. Die Bindigkeit erhält man auch mit der Formel 8-n, wobei n die Hauptgruppenzahl ist.
Regeln zum Aufstellen von LEWIS-Formeln in einfachen Fällen
1. Schreibe zunächst die Summenformel des Stoffs auf.
Beispiel Ammoniak: NH3
2. Ermittle die Anzahl an Elektronenpaaren in diesem Ammoniak-Molekül
N hat 5 e- und kommt 1x vor => 5 e-
H hat 1 e- und kommt 3x vor => 3 e-
Insgesamt: 8 e-
8 : 2 = 4 Elektronenpaare im Molekül
3. Ermittle die Anzahl an Bindungen im Molekül
Überlege nun wie viele Valenzelektronen die jeweiligen Atome des Moleküls zur Erfüllung der Edelgaskonfiguration benötigen. Mulitpliziere dann mit der Anzahl der Atomsorte:
N: 8 e- x 1 = 8
H: 2 e- x 3 = 6
8 + 6 = 14
14 : 2 = 7
Nun wird von diesem Ergebnis die oben errechnete Anzahl an Elektronenpaaren, also 4, subtrahiert.
Das Ergebnis: 3 Bindungen!
3. Man bestimmt das Zentralatom
Das Zentralatom ist das Atom, welches nur einmal in der Formel vorkommt und die meisten Bindungen aufbauen kann. Nun gruppiert man die anderen Atome durch eine Einfachbindung jeweils im 90°-Winkel um das Zentralatom herum. Sollte es kein Zentralatom geben, wird dieser Schritt weggelassen.
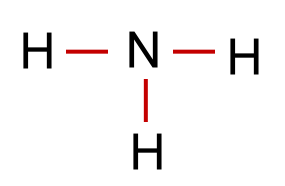 Nun sind in unserem Beispiel 6 (3 Elektronenpaare) von den 8 Valenzelektronen in der Formel für die 3 Bindungen verbaut worden. Es gibt also noch 1 nicht bindendes Elektronenpaar.
Nun sind in unserem Beispiel 6 (3 Elektronenpaare) von den 8 Valenzelektronen in der Formel für die 3 Bindungen verbaut worden. Es gibt also noch 1 nicht bindendes Elektronenpaar.
4. Verteilung der verbleibenden Elektronenpaare
Die restlichen Elektronenpaare werden so verteilt, dass jedes Atom eine voll besetzte Valenzschale erhält.
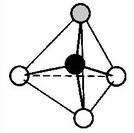
Das Elektronenpaarabstoßungs-Modell von Gillespie
(VSEPR-Modell: Valence Shell Electron Pair Repulsion, Valenzschalen-Elektronenpaar-Abstoßungsmodell)
- Bindende Elektronenpaare haben zueinander den größtmöglichsten Abstand. Mehrfachbindungen haben den gleichen Raumbedarf wie Einfachbindungen. Der Raumbedarf eines bindenden Elektronenpaares sinkt mit steigender Elektronegativität.
- Freie Elektronenpaare haben prinzipiell den gleichen Einfluss auf den Bau eines Moleküls wie Bindungselektronenpaare. Allerdings beanspruchen freie Elektronenpaare etwas mehr Raum als Bindungselektronenpaare.
 Aus diesen Überlegungen ergibt sich für das Ammoniak-Molekül ein Tetraeder, der jedoch wegen der Regel 2 einen Bindungswinkel(H-N-H) von 107,0° statt des Tetraederwinkels von 109,5° hat.
Aus diesen Überlegungen ergibt sich für das Ammoniak-Molekül ein Tetraeder, der jedoch wegen der Regel 2 einen Bindungswinkel(H-N-H) von 107,0° statt des Tetraederwinkels von 109,5° hat.
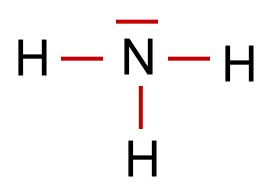
 Um die räumliche Struktur, die sich nach den Überlegungen von Gillespie ergibt, in einer Strukturformel (Lewis-Formel) noch besser zum Ausdruck zu bringen, kann man Bindungen, die hinter der Papierebene liegen mit einem schraffierten Keil kennzeichnen und Bindungen, die vor der Papierebene liegen – also zum Betrachter zeigen – mit einem ausgefüllten Keil.
Um die räumliche Struktur, die sich nach den Überlegungen von Gillespie ergibt, in einer Strukturformel (Lewis-Formel) noch besser zum Ausdruck zu bringen, kann man Bindungen, die hinter der Papierebene liegen mit einem schraffierten Keil kennzeichnen und Bindungen, die vor der Papierebene liegen – also zum Betrachter zeigen – mit einem ausgefüllten Keil.