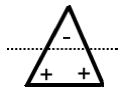
"Tauziehen"
Folgende Ausführungen werden dir zeigen, warum Wasser so spezielle Eigenschaften - wie gerade erwähnt- besitzt.
Die Elektronegativität
Ein Atomkern mit seinen positiven Protonen hält die eigenen Elektronen der Atomhülle fest, da sich entgegen gesetzte Ladungen (also plus und minus) anziehen. Bei einer Atombindung (Bindung zwischen zwei Atomen), also der gemeinsamen Benutzung von Elektronen, wirkt diese Kraft nicht nur auf die eigenen Elektronen sondern auch auf die Bindungselektronen des anderen "Partner-Atoms". Diese Wirkung nennt man Elektronegativität.
 Elektronegativität (EN) ist das Bestreben eines Atoms an Bindungselektronen zu ziehen.
Elektronegativität (EN) ist das Bestreben eines Atoms an Bindungselektronen zu ziehen.
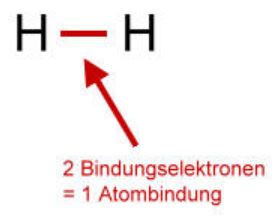
Sind bei einer Atombindung gleiche Elemente beteiligt, so ziehen auch beide Atomkerne gleich stark an den Bindungselektronen.
In einem solchen Fall sind die Bindungselektronen zwischen den Atomen gleichmäßig verteilt, wie z.B. beim Wasserstoff-Molekül (Bild links).
Nun zieht jedoch jedes Element unterschiedlich stark an Bindungselektronen. Mit anderen Worten: Jede Atomsorte (Element) besitzt eine charakteristische Elektronegativität. Fluor hat die stärkste Elektronegativität. Diesem Element hat PAULING den Zahlenwert 4 zugeordnet.
Hier nun die Werte aller Hauptgruppenelemente. Die Elemente, deren Elektronegativitätswerte am häufigsten benötigt werden, sind gelb hervorgehoben.
Sind unterschiedliche Elemente an einer Atombindung beteiligt, so ziehen die Atome unterschiedlich stark an den Bindungselektronen. Das Atom mit dem höheren Elektronegativitätswert zieht stärker.
Ist die Elektronegativitätsdifferenz größer als 0,5, so verschieben sich die Bindungselektronen so stark, dass es zu einer Ladungsverschiebung im Molekül kommt.
Beispiel: Das Chlorwasserstoff-Molekül
 Ist die Elektronegativitätsdifferenz ΔEN der an einer Atombindung beteiligten Atome größer als 0,5, so entstehen polare Atombindungen und Partialladungen.
Ist die Elektronegativitätsdifferenz ΔEN der an einer Atombindung beteiligten Atome größer als 0,5, so entstehen polare Atombindungen und Partialladungen.
Die Elektronegativität ist eines der wichtigsten Phänomene in der Chemie. So hat dieser Umstand z.B. beim Wasser-Molekül weitreichende Folgen, wie wir noch sehen werden.
Elektronegativität beim Wasser-Molekül
Ein Sauerstoff-Atom hat aufgrund seiner großen Kernladung (8 Protonen) ein großes Bestreben die Bindungselektronen der Wasserstoff-Atome zu sich zu ziehen. Dieses Bestreben nennt man, wie im vorigen Artikel beschrieben, ElektronegativitätLex. Sie ist – als Faustregel – größer, je weiter rechts das Element im PSE steht.
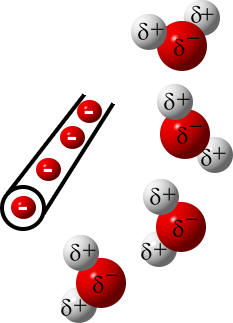
Beim Wassermolekül entstehen dadurch Ladungsverschiebungen, da Elektronen ja negativ geladen sind. Der Chemiker symoblisiert solche Teilladungen (Partialladungen) mit dem kleinen griechischen Buchstaben δ (Delta), das unserem "d" entspricht.
 Wasser-Moleküle sind Dipolmoleküle, sie besitzen Partialladungen (Teilladungen, delta minus und delta plus) und polare Atombindungen.
Wasser-Moleküle sind Dipolmoleküle, sie besitzen Partialladungen (Teilladungen, delta minus und delta plus) und polare Atombindungen.
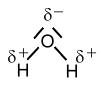 |
 |
 |
|
Valenzstrichformel |
Modell | schematische Darstellung |
Das Wassermoleküle "Plus- und Minus-Pole" besitzen, lässt sich mit dem bereits oben gezeigten Experiment bestätigen:
Mit Hilfe eines Katzenfells kann man einen Gummistab elektrostatisch aufladen.
Du kennst sicherlich solche Aufladungen aus dem Alltag (plötzlich stehen deine Haare nach dem Kämmen mit einem Plastikkamm zu Berge, beim Anfassen eines metallischen Gegenstandes bekommt man unter bestimmten Voraussetzungen einen kleinen elektrischen Stromschlag usw.)
Die Dipolmoleküle richten sich so aus, dass ihre positiven Teilladungen zum negativ geladenen Gummistab zeigen. Andererseits richten sie sich auch so aus, dass sich die Wassermoleküle untereinander anziehen.


 Valenzstrichformel (Lewisformel) eines Chlorwasserstoff-Moleküls.
Valenzstrichformel (Lewisformel) eines Chlorwasserstoff-Moleküls.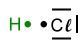 Darstellung, um die Zugehörigkeit der Elektronen zu zeigen (ein Punkt = ein Elektron, ein Strich = zwei Elektronen).
Darstellung, um die Zugehörigkeit der Elektronen zu zeigen (ein Punkt = ein Elektron, ein Strich = zwei Elektronen).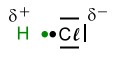 Die Elektronegativitätsdifferenz ΔEN beträgt 0,9 (3,0-2,1). Das Bindungselektron vom Wasserstoff wird stärker zum Chlor-Atom hin gezogen. Da Elektronen negative Ladungen besitzen, verschiebt sich nun auch die Ladung innerhalb des Moleküls. Es entsteht eine sogenannte
Die Elektronegativitätsdifferenz ΔEN beträgt 0,9 (3,0-2,1). Das Bindungselektron vom Wasserstoff wird stärker zum Chlor-Atom hin gezogen. Da Elektronen negative Ladungen besitzen, verschiebt sich nun auch die Ladung innerhalb des Moleküls. Es entsteht eine sogenannte  Die Größe und Richtung dieser Ladungsverschiebung kann man mit einem Vektorpfeil kennzeichnen. Die Größe des Pfeils gibt auch die Größe der Verschiebung an. Der Peil zeigt immer von der positiven Ladung zur negativen.
Die Größe und Richtung dieser Ladungsverschiebung kann man mit einem Vektorpfeil kennzeichnen. Die Größe des Pfeils gibt auch die Größe der Verschiebung an. Der Peil zeigt immer von der positiven Ladung zur negativen.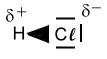 Manchmal findet man für die Darstellung der
Manchmal findet man für die Darstellung der  Die übliche Schreibweise ist jedoch die Valenzstrichformel (Lewisformel) mit Kennzeichnung der Partialladungen.
Die übliche Schreibweise ist jedoch die Valenzstrichformel (Lewisformel) mit Kennzeichnung der Partialladungen.
 Valenzstrichformel (Lewisformel) eines Wasser-Moleküls.
Valenzstrichformel (Lewisformel) eines Wasser-Moleküls.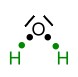 Darstellung, um die Zugehörigkeit der Elektronen zu zeigen (ein Punkt = ein Elektron, ein Strich = zwei Elektronen).
Darstellung, um die Zugehörigkeit der Elektronen zu zeigen (ein Punkt = ein Elektron, ein Strich = zwei Elektronen). Die Elektronegativitätsdifferenz ΔE zwischen dem Sauerstoff-Atom und dem Wasserstoff-Atom beträgt 1,4 (3,5-2,1). Das Bindungselektron vom Wasserstoff wird stärker zum Sauerstoff-Atom hin gezogen. Da Elektronen negative Ladungen besitzen, verschiebt sich nun auch die Ladung innerhalb des Moleküls. Es entsteht eine sogenannte
Die Elektronegativitätsdifferenz ΔE zwischen dem Sauerstoff-Atom und dem Wasserstoff-Atom beträgt 1,4 (3,5-2,1). Das Bindungselektron vom Wasserstoff wird stärker zum Sauerstoff-Atom hin gezogen. Da Elektronen negative Ladungen besitzen, verschiebt sich nun auch die Ladung innerhalb des Moleküls. Es entsteht eine sogenannte  Die Größe und Richtung dieser Ladungsverschiebung kann man mit Vektorpfeilen kennzeichnen. Die Größe eines Pfeils gibt auch die Größe der Verschiebung an. Der Peil zeigt immer von der positiven Ladung zur negativen.
Die Größe und Richtung dieser Ladungsverschiebung kann man mit Vektorpfeilen kennzeichnen. Die Größe eines Pfeils gibt auch die Größe der Verschiebung an. Der Peil zeigt immer von der positiven Ladung zur negativen.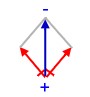





Kommentare