A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Begriffe, Tabellen etc. mit Kontexthinweisen

A
nach oben
Adsorption und Absorption
Adsorbieren bedeutet, dass sich ein Stoff an einem anderen Stoff anlagert.
-
-
- Kontext: AktivkohleLex
- Kontext: Trinkwasserfilter
- Kontext: Färbeverfahren für natürliche Textilien (Küpenfärbung)
- Kontext: Hydrierung an Alkenen
Absorption hingegen bedeutet, dass ein Stoff durch einen anderen aufgenommen wird.
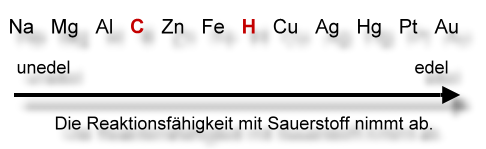
Affinitätsreihe bzw. Oxidationsreihe
Affinität bedeutet "Zuneigung". Hier ist die Zuneigung zum Element Sauerstoff gemeint, also die Reaktionsfähigkeit mit Sauerstoff.
Rot: Nichtmetalle.
Einige wichtige Elemente:
Aktivierungsenergie
Aktivkohle
Feinkörnige Kohle mit vielen Hohlräumen, die dadurch eine sehr große Oberfläche besitzt. Sie wird vor allem als AdsorptionsmittelLex verwendet.
Alchemisten
Die Alchemisten waren Anhänger der sogenannten Alchemie, eine mehr oder weniger geheime Naturphilosophie, die sich unter anderem zur Aufgabe gemacht hatte aus unedlen Metallen mit Hilfe des Stein der Weisen (eine Substanz, die man heute als Katalysator bezeichnen würde) Gold oder Silber herzustellen, was freilich nicht gelang. Im 17./18. Jahrhundert wurde die Alchemie nach und nach durch die Chemie und Pharmakologie (Wissenschaft, die sich mit den Wechselwirkungen von Stoffen und Lebewesen beschäftigt) abgelöst. Gleichwohl verdanken wir den Alchemisten z.B. die Wiederentdeckung des Porzellans oder die Entdeckung des weißen Phosphors (durch Hennig Brand, 1669).
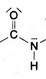
Aldehyde
Alkohole
Aluminium - ein unedles Metall
Wichtigstes Leichtmetall, sehr dehnbar (Folien, Tuben), gute Leitfähigkeit für Wärme und Elektrizität.
Für Flugzeug- und Schiffsbau, Folien (Alufolie) und Gefäße.
Metallgewinnung und Schweißen mit Thermit.
Amino-Gruppe
Amine besitzen die Amino-Gruppe. Ausgehend vom Ammoniak (NH3) unterscheidet man, je nachdem wie viele Wasserstoff-Atome ersetzt wurden, zwischen primären, sekundären und tertiären Aminen bzw. Amino-Gruppen.

Aminosäuren
Analyse
Analyse bedeutet Untersuchung. In der Chemie wird dieser Begriff auch oft im Sinne einer Zerlegung bzw. Trennung von Stoffen verwendet.
Anionen
asymmetrisches Kohlenstoff-Atom
Atombindung
Andere Bezeichnungen: Elektronenpaarbindung, kovalente Bindung
Atome binden sich untereinander "aus eigenem Interesse". Atome sind bestrebt, eine vollbesetzte Außenschale (nach dem Schalenmodell) zu erhalten bzw. im äußeren Aufenthaltsbereich alle Kugelwolken doppelt zu besetzen (nach dem Kugelwolkenmodell). Sie sind also bestrebt die EdelgaskonfigurationLex zu erhalten.
Um dies zu erreichen gibt es unterschiedliche Möglichkeiten. Bei einer Atombindung benutzen die Atome, die an der Bindung beteiligt sind, gemeinsam Elektronen.
Atommodelle - Übersicht
polare Atombindung
Atommasseneinheit
Die Masse eines Atoms wird in der Atommasseneinheit „unit“ angegeben (Abk. u).
Ein Wasserstoff-Atom besitzt die Masse von ca. 0,000 000 000 000 000 000 000 001 674 g (= 1,661 · 10-24 g). Das entspricht 1 u.
Die genaue Definition ist: 1/12 der Masse des Kohlenstoff-Isotops 12C.
Die Atommasseneinheit ist sinnvoll. Du würdest die Strecke von Berlin nach Paris auch nicht in mm angeben.
Autoprotolyse des Wassers
Avogadro
 1776-1856
1776-1856
[1]
Die Avogadrozahl gibt die Zahl der Teilchen in einem MolLex an.
NA= 6 · 1023 pro Mol
Die Avogadro-Zahl ist der Kehrwert der atomaren MasseneinheitLex in Gramm.
-
- Kontext: Welche Masse hat ein Magnesium-Atom?
B
nach oben
Basen
Basen sind im Sinne von Brönsted Stoffe bzw. Moleküle, die Protonen (Wasserstoff-Ionen) aufnehmen können. Der Begriff ist weiter gefasst als der Begriff Lauge. Bei Laugen handelt es sich "nur" um die wässrigen Lösungen von Alkali- und Erdalkalihydroxiden (alkalische Lösungen).
C
nach oben
Carbonyl-Gruppe
Siehe funktionelle Gruppen
Carboxy-Gruppe (früher Carboxyl-Gruppe)
Siehe funktionelle Gruppen
D
nach oben
DALTON (Kugelmodell) (1808)
Nach DALTON besteht Materie aus Atomen. Diese Atome kann man sich als winzige kleine Kugeln vorstellen.
-
- Atome sind unteilbar und können weder geschaffen noch zerstört werden.
- Es gibt genauso viele Atomsorten, wie es Elemente gibt.
- Alle Atome eines Elementes sind gleich groß und gleich schwer.
- Atomumwandlungen sind nicht möglich. (Der Versuch der Alchemisten Eisen in Gold umzuwandeln ist demnach sinnlos.)
- Bei chemischen Reaktionen werden die Atome der Ausgangsstoffe neu angeordnet und in bestimmten Anzahlverhältnissen miteinander verknüpft.
Nachteile, also Grenzen dieses Modell:
-
- Es erklärt nicht die chemischen Vorgänge bzw. die Ursache für chemische Bindungen.
- Es kann elektrische und magnetische Erscheinungen nicht deuten.
- Es kann die Ordnung der Elemente im Periodensystem (das damals noch sehr lückenhaft war) nicht deuten.
- Es geht von keiner inneren Struktur der Atome aus, kann also z.B. das Phänomen der Radioaktivität (und der Spektrallinien) nicht erklären.
- Es kann nicht das Phänomen der Radioaktivität deuten.
- Ursache und Bedeutung der Spektrallinien sind mit dem Modell nicht zu erklären.
- Das Modell selbst liefert keinen Beweis für die Existenz von Atomen.
- [Erst durch Einsteins mathematischer Beschreibung der Brownschen Molekularbewegung oder durch die Erkenntnisse der Radioaktivität konnten Beweise geliefert werden.]
- Daltons Atomhypothese stand im Widerspruch mit einigen Experimenten, die an Gasen vorgenommen worden sind: Gay-Lussac und Humboldt hatten entdeckt, dass bei allen Gasreaktionen die Volumina der miteinander reagierenden Gase und der entstehenden gasförmigen Produkte im Verhältnis einfacher ganzer Zahlen stehen.
Nach Avogadro enthalten bei gleicher Temperatur und unter gleichem Druck im gleichen Volumen alle Gase die gleiche Zahl von Teilchen. Aus diesen beiden Erkenntnissen musste man annehmen, dass die kleinsten Teilchen der gasförmigen Elemente teilbar sind. Das widersprach jedoch Daltons Atomhypothese.
Die Lösung des Problems ergab sich bei der Annahme, dass die kleinsten Baueinheiten der Gase aus Molekülen bestehen.
Demokrit
Dipol-Dipol-Wechselwirkungen
Dipol-Dipol-Wechselwirkungen sind zwischenmolekulare Wechselwirkungen, die durch permanente unsymmetrische Ladungsverteilung zustande kommen. Damit gehören sie zu den Keesom-Kräften. Ist bei den Dipol-Dipol-Wechselwirkungen ein polarisiertes Wasserstoff-Atom beteiligt, dann spricht man von "Wasserstoffbrücken". Diese sind also ein Sonderfall der Dipol-Dipol-Wechselwirkungen.
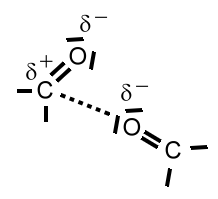
Beispiel: Dipol-Dipol-Wechselwirkung zwischen Ethanal-Molekülen
E
nach oben
Edelgaskonfiguration
Besitzt ein AtomLex oder IonLex eine mit Elektronen voll besetzte äußere Schale (nach dem erweiterten Kern-Hülle-Modell = Schalenmodell) bzw. voll besetzte Kugelwolken im äußeren Aufenthaltsbereich (nach dem Kugelwolkenmodell), so spricht man von der Edelgaskonfiguration. Die äußerste Schale wird auch Valenzschale genannt.
Nach dem KugelwolkenmodellLex sind bei einer Edelgaskonfiguration alle Kugelwolken im äußersten Aufenthaltsbereich mit zwei Elektronen voll besetzt.
Die Edelgas-Atome besitzen von Hause aus eine vollbesetzte Valenzschale bzw. voll besetzte Kugelwolken.
Andere Atome müssen hierzu ...
Entweder ...
Elektronen aufnehmen (Nichtmetalle) oder Elektronen abgeben (Metalle). So entstehen Ionen: positiv geladene (Kationen) und negativ geladene (Anionen). Die Metalle müssen dabei alle Elektronen der Valenzschale abgeben. Befindet sich kein Elektron mehr auf einer Schale, so existiert die Schale auch nicht und die vorher darunter liegende Schale ist jetzt die voll besetzte Schale.
Oder ...
Die Atome benutzen Elektronen eines anderen Atoms mit (Schalenmodell). Siehe auch: OktettregelLex. Hierbei entsteht die so genannte Atombindung. Sind zwei oder mehr Atome auf diese Art miteinander gebunden, so spricht man von einem MolekülLex.
Nach dem Kugelwolkenmodell erreicht ein Atom die Edelgaskonfiguration, indem die Kugelwolken, die nur ein Elektron besitzen, mit anderen halb besetzen Kugelwolken eines anderen Atoms verschmelzen. So entstehen Bindungswolken.
Elektrolyse
Bei einer Elektrolyse werden mit Hilfe von Strom Ionen in Atome umgewandelt. Dies geschieht gewöhnlich in einer wässrigen Salzlösung.
Bei einer Schmelzflusselektrolyse wird das feste Salz, nicht die Salzlösung, für die Elektrolyse benutzt.
nach oben
Elektronegativität (Basiswissen -extrem wichtig!)
Als Elektronegativität bezeichnet man die Fähigkeit eines Atom, Bindungselektronen zu sich zu ziehen. Diese Fähigkeit ist gemessen worden und zahlenmäßig im Vergleich zu allen Elementen in Beziehung gesetzt worden:

Den höchsten Elektronegativitätswert hat demnach Fluor.
Interessant ist die Elektronegativitätsdifferenz. Sie zeigt, wie stark Bindungselektronen verschoben werden. Bei einer Elektronegativitätsdifferenz von mindestens 0,5 kann man davon ausgehen, dass Ladungsverschiebungen sich auf die Eigenschaften des Stoffes auswirken. Solche polaren Moleküle - wie z.B. Wasser oder Ethanol - sind (sofern der Ladungsschwerpunkt aufgrund der Geometrie der Moleküle nicht zusammen fällt) gut wasserlöslich und haben im Vergleich zu anderen Stoffen mit ähnlicher Molekülmasse eine vergleichsweise hohe Siedetemperatur.
Elektronen
Elektronen sind (einfach) negativ geladene Elementarteilchen eines Atoms. Sie befinden sich in der Atomhülle und haben fast keine Masse.
Elektronenkonfiguration
Element
Element = Atomsorte = Urstoff. Es gibt 118 Atomsorten, die im Periodensystem der Elemente (PSE) aufgeführt sind. Diese Atomsorten nennt man Elemente. 92 davon kommen natürlich vor (gebunden oder elementar - siehe weiter unten), die anderen sind vom Menschen künstlich hergestellt worden. Besteht ein Stoff nur aus einer Atomsorte, so muss es sich also um ein Element handeln. Andernfalls handelt es sich um eine VerbindungLex.
Merke:
Elemente sind Reinstoffe, die nur aus einer Atomsorte bestehen.
Früher dachte man, dass es nur vier Elemente gibt (Erde, Feuer, Wasser, Luft). Jedoch handelt es sich im chemischen Sinne nicht um Elemente. Erde besteht vorwiegend aus der Verbindung Siliciumoxid, Feuer sind brennende Gase, Wasser ist eine Verbindung aus den Elementen Wasserstoff und Sauerstoff und Luft ist ein Gemisch aus verschiedenen Elementen und Verbindungen mit dem Hauptbestandteil Stickstoff.
Der wissenschaftliche Begriff Element wurde vor allem von ROBERT BOYLE (1627-1691) eingeführt.
Ein Element ist ein Reinstoff, der durch chemische Methoden nicht weiter zerlegt werden kann.
Die heutige Vorstellung von den Elementen geht vor allem auf JOHN DALTON zurück.
Im engeren Sinne bezeichnet man ein Element als einen Urstoff, wobei viele Elemente als Stoff nicht in unserer Umwelt natürlich vorkommen (z.B. Natrium). Man sagt auch: Das Element kommt nicht elementar vor. Allerdings sind die Atome von Elementen mit anderen Atomen von anderen Elementen in sogenannten Verbindungen gebunden. Man sagt dann: Das Element kommt in gebundener Form vor. Allerdings muss man dabei eines berücksichtigen, das allerdings auch recht schwierig zu begreifen ist: Ein Stoff, der durch eine chemische Reaktion von unterschiedlichen Elementen entstanden ist, hat nichts, aber auch gar nichts mehr mit den Ausgangsstoffen (Edukten gemeinsam) - auch, wenn in der Formel des Reaktionsproduktes die Elemente mit ihren Symbolen enthalten sind!
Die Elementsymbole können Unterschiedliches bedeuten:
H = Abkürzung für das Element Wasserstoff
Der Reinstoff Wasserstoff kommt jedoch nur molekularLex vor. Das heißt, jeweils zwei Wasserstoff-Atome binden sich. Daher schreibt man, wenn man das Gas Wasserstoff meint: H2.
H = Symbol für ein Wasserstoff-Atom (z.B. in einer Summenformel oder in einer Strukturformel)
H+ = Ist kein Element (mehr). Es ist entstanden, indem ein Wasserstoff-Atom sein Elektron verloren hat. Die Folge ist eine positive Ladung (Proton). Andere Eigenschaft - anderer Stoff! Dieses Wasserstoff-Ion ist das Säureteilchen. Es ist für alle typischen Eigenschaften von Säuren verantwortlich.
Diese kleinen Unterschiede sind entscheidend! In der Mineralwasserflasche ist eben nicht das in Wasser explodierende Natrium oder das Kampfgas Chlor enthalten, wohl aber Natrium- und Chlorid-Ionen, die für uns sogar lebensnotwendig sind.
Siehe auch VerbindungLex.
Endotherm
Ist die bei einer chemischen Reaktion frei werdende Energiemenge kleiner als die zuvor zugefügte AktivierungsenergieLex, so spricht man von einer endothermen Reaktion.
Ester
Die Moleküle dieser Stoffklasse enthalten eine Ester-Gruppe als funktionelle Gruppe:
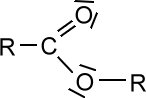
Ester entstehen, wenn Carbonsäuren mit Alkoholen reagieren.
Die kurzkettigen Ester sind oft Duft- und Aromastoffe, während die langkettigen Ester Stoffe wie z.B. Wachse darstellen.
Exotherm
Ist die bei einer chemischen Reaktion frei werdende Energiemenge größer als die zuvor zugefügte AktivierungsenergieLex, so spricht man von einer exothermen Reaktion.
F
nach oben
Funktionelle Gruppe
Eine funktionelle Gruppe ist eine Gruppierung von unterschiedlichen Atomen, welche für die typischen Eigenschaften (physikalische und chemische) einer Stoffklasse ausschlaggebend verantwortlich sind.
Diesbezüglich sind besonders wichtig:
-
- Polare AtombindungenLex
- Partialladungen (Teilladungen)
- Freie Elektronenpaare, also ElektronenLex, die für keine chemische Bindung benutzt werden. Allerdings spielen solche freien Elektronenpaare für zwei andere Phänomene eine wichtige Rolle:
- Mesomerie (Delokalisierung von Elektronen)
- Basische Eigenschaft nach Brönsted: Aufnahme von Protonen.
Folgende Funktionelle Gruppen sind für die Schulchemie wichtig:
- Hydroxy-Gruppe (Alkohole)
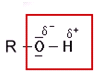 Als Summenformel bzw. Halbstrukturformel: R-OH
Als Summenformel bzw. Halbstrukturformel: R-OH
- Carbonyl-Gruppe
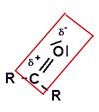 Als Summenformel bzw. Halbgrukturformel: R-CO-R
Als Summenformel bzw. Halbgrukturformel: R-CO-R
- Sind beide Reste Alkyl-Reste, dann handelt es sich um ein Keton.
- Ist ein Rest ein Wasserstoff-Atom, dann handelt es sich um eine Aldehyd.
- Ist ein Rest eine Hydroxy-Gruppe, dann handelt es sich um eine Carbonsäure. Die funktionelle Gruppe nennt man dann Carboxy-Gruppe.
- Ein Ester besitzt ebenfalls eine Carbonyl-Gruppe.
-
- Kontext: Vom Alkohol zum Aldehyd
- Aldehyd-Gruppe (Aldehyde)
- Carboxy-Gruppe (früher: Carboxyl-Gruppe); funktionelle Gruppe der Carbonsäuren (Alkansäuren)
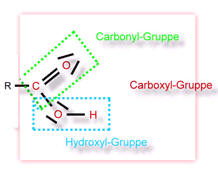
- Ester-Gruppe (z.B. Fette)

- Ether-Gruppe
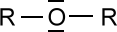
- Amino-Gruppe
- Nitro-Gruppe
- Azo-Gruppe
G
nach oben
Gesetz von der Erhaltung der Masse
Die Masse der Ausgangsstoffe und die Masse der Reaktionsprodukte ist - wenn die Reaktion in einem geschlossenem SystemLex stattfindet - gleich.
Gemisch
Bei einem Gemisch sind verschiedene Reinstoffe miteinander vermengt (vermischt) worden. Ein Gemisch besteht also aus verschiedenen Reinstoffen.
Siehe auch Reinstoff!Lex
H
nach oben
Hydration bzw. Hydratation; Hydrathülle
Die Umhüllung eines Ions mit Lösemittel-Moleküle wird Solvation oder Solvatisierung genannt. Im Fall von Wassermolekülen spricht man von einer Hydration bzw. Hydratation. So sind z.B. Natrium-Ionen in Wasser hydratisiert. Das Symbol hierfür ist (aq) - von aqua = lat. Wasser. Die Begriffe sind leicht mit dem Begriff HydratisierungLex zu verwechseln!
Beispiel:
3 Na+(aq) bedeutet also: Drei einzelne Natrium-Ionen, die jeweils von einer Hydrathülle umhüllt sind. Die Hydrathülle führt dazu, dass sich entgegengesetzt geladene Ionen im Wasser nicht mehr anziehen können. Somit sind sie in Wasser frei beweglich. Da die Ionen einzeln sind, sind sie für uns auch nicht sichtbar!
-
-
Kontext: Wasser als Lösemittel (Niveau 1)
-
-
Kontext: Lösevorgang von Salzen (Gitterenergie, Hydrationsenergie, Lösewärme)
-
Kontext: Löslichkeit von Salzen
-
Kontext: Hydration von Wasserstoff-Ionen und Säurerest-Ionen
-
(Dissoziation von Säuren nach Arrhenius)
Hydratisierung
Eine chemische Reaktion, bei der an einer C=C Doppelbindung Wasser angelagert wird, nennt man auch Hydratisierung.
Hydroxy-Gruppe
Siehe funktionelle Gruppen
I
nach oben
Ionen
Ionen sind Teilchen oder Teilchenverbände, die negativ oder positiv geladen sind. Sie besitzen mehr oder weniger Elektronen als Protonen.
Positiv geladene Ionen heißen mit allgemeinem Namen Kationen.
Negativ geladene Ionen heißen mit allgemeinem Namen Anionen.
Isomerie
J
nach oben
K
nach oben
Kohlenstoff

Das ElementLex Kohlenstoff ist aus vielerlei Gründen für den Chemiker wichtig:
- Kohlenstoffatome sind Bestandteil sogenannter Organischer Verbindungen
- Kontext: Organische Chemie
- Kontext:
- Das Element Kohlenstoff selbst kommt in verschiedenen ModifikationenLexvor.
- Die Verbrennungsprodukte des Kohlenstoffs
- Kreislauf des Kohlenstoffs
Konjugiertes System
Im engeren Sinne bezeichnet ein konjugiertes System das Abwechseln von Einfachbindungen/Doppelbindungen.
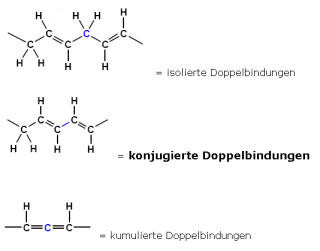
Bei Doppelbindungen lässt sich ein Elektronenpaar leicht verschieben (siehe auch Mesomerie). Auch nichtbindende Elektronenpaare lassen sich leicht verschieben. Daher ist auch ein System wie in dem nachfolgenden Beispiel abgebildet, ein konjugiertes System:
Kugelwolkenmodell (KWM)
L
nach oben
Lachgas
Lasgas ist der Trivialnamefür Distickstoffmonooxid.
LEWIS-Formel (Strukturformel, Valenzstrichformel)
Eine Lewis-Formel liefert mehr Informationen als eine Summenformel. Sie zeigt den Bau eines Moleküls oder eines mehratomigen Ions.
M
nach oben
Mesomerie
Als Mesomerie (Resonanz) wird die Erscheinung bezeichnet, dass die in einem Molekül (oder mehratomigen Ion) vorliegenden Bindungsverhältnisse nicht durch eine einzige Strukturformel dargestellt werden können, sondern nur durch mehrere fiktive Grenzformeln (Mesomerieformeln) bzw. Grenzformen, gewissermaßen Extremfälle, die durch Umlagerung von Elektronenpaaren gebildet werden können. Die Mesomerieformeln werden mit Hilfe des Mesomeriepfeils unterschieden:

Mol
Molekül
Ein Molekül ist die kleinste Baueinheit eines Stoffes mit einer typischen Zusammensetzung von mehreren Atomen. Dabei können gleiche oder ungleiche Atomsorten miteinander (durch Atombindungen) gebunden sein. Alle Moleküle eines Stoffes sind gleich.
Befinden sich in einem Molekül eines Stoffes nur gleiche Atome, so handelt es sich um ein ElementLex.
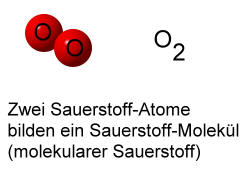
Sollte (als "Zwischenschritt" bei einer chemischen Reaktion) der Sauerstoff als einzelne, freie Atome vorkommen, so spricht man von elementarem oder auch atomarem Sauerstoff.
Sind unterschiedliche Atomsorten miteinander gebunden, so handelt es sich um eine VerbindungLex.

molekular
Es gibt einige Elemente, die von Natur aus nicht als einzelne Atome vorkommen. Bei diesen Elementen bilden meistens zwei Atome ein Molekül.
Lerne diese Elemente auswendig!
Wasserstoff H2
Sauerstoff O2
Stickstoff N2
und die Halogene: Fluor F2, Chlor Cl2, Brom Br2 und Iod I2
Molekülmasse
Um die Masse eines bestimmten Moleküls zu berechnen, werden die Atommassen der Atome, die in dem Molekül gebunden sind, addiert.
N
nach oben
O
nach oben
Oktettregel
Atome in VerbindungenLex versuchen durch gemeinsame Benutzung von ValenzelektronenLex die stabile Elektronenkonfiguration des im PSE benachbarten Edelgases zu erlangen (Edelgaskonfiguration).
Atome von Elementen der 2. Periode versuchen auf diese Weise acht (octa) Valenzelektronen zu besitzen. Es können auf diese Art maximal vier Atombindungen (kovalente Bindungen, Elektronenpaarbindungen) ausgebildet werden.
Dies liegt daran, dass nur vier Orbitale auf der äußeren Schale (Valenzschale) [2s, drei 2p] für Bindungen zur Verfügung stehen.
-
- Kontext: Kugelwolkenmodell
Organische Verbindungen bzw. Organische Chemie
Oxidation
Der Begriff kann, je nach Schwierigkeitsgrad, verschieden gedeutet werden:
Oxidationszahl
P
nach oben
Protonen
Protonen sind (einfach) positiv geladene Elementarteilchen im Kern eines Atoms. Ein Proton besitzt die Masse von ca. 1,7 · 10-24 g bzw. ca. 1 u (unit = Atommasseneinheit)
Q
nach oben
Quadrupol-Wechselwirkung
R
nach oben
Reagenz
Reagenzien sind Lösungen, die für einen gezielten Nachweis von Stoffen benutzt werden.
Reaktionsprodukt
Reaktionsschema
Ein Reaktionsschema gibt an, aus welchen Ausgangsstoffen (Edukten) neue Stoffe (Reaktionsprodukte) bei einer chemischen Reaktion entstehen und ob diese Reaktion exotherm oder endotherm ist.
Ein gängiger Ausdruck ist: "Formuliere das Reaktionsschema ...".
Hier soll kein Aufsatz über die Reaktion geschrieben werden, sondern ein Reaktionsschema aufgestellt werden!
Man kann Reaktionsschemata in verschiedenen Formen aufstellen:
Nach Zunahme des Informationsgehaltes bzw. Schwierigkeitsgrades geordnet:
1. Allgemeines Reaktionsschema in Worten bzw. allgemeines Wort-Reaktionschema:
Ausgangsstoffe (Edukte) → Reaktionsprodukte /endotherm oder exotherm
Beispiele:
a) Nichtmetall + Sauerstoff → Nichtmetalloxid / exotherm
b) Säure + unedles Metall → Salz + Wasserstoff / exotherm
2. Reaktionsschema in Worten (bzw. Wort-Reaktionsschema):
Beispiele:
a) Wasserstoff + Sauerstoff → Wasser / exotherm
b) Salzsäure + Zink → Zinkchlorid + Wasserstoff / exotherm
3. Reaktionsschema in Symbolformelschreibweise
Beispiele:
a) 2 H2 + O2 → H2O / exotherm
b) 2 HCl(l) + Zn → ZnCl2 + H2 / exotherm
Da bei einem Reaktionsschema in Symbolformelschreibweise auch deutlich wird, dass die Anzahl der Atome links und rechts vom Reaktionspfeil gleich ist und demzufolge auch die Masse der Ausgangsstoffe und der Reaktionsprodukte gleich ist, wird ein solches Reaktionsschema auch oft Reaktionsgleichung genannt. Reaktionsgleichungen bestehen aus Formeln mit ihren stöchiometrischen Zahlen (das sind die großen Zahlen vor den Formeln). Formeln wiederum bestehen aus Elementsymbolen.
Der Begriff "Reaktionsgleichung" ist ungünstig, da es sich nicht um eine mathematische Gleichung handelt. Edukte und Reaktionsprodukte sind eben nicht gleich. Aus diesem Grund wird der Begriff Reaktionsschema bevorzugt.
Die Schreibweise von Molekülen mit Hilfe der Elementsymbole bezeichnet man auch als Summenformel. Salze bestehen nicht aus Molekülen, sondern aus Ionenverbänden. In diesen Fällen gibt die Symbolformel das Anzahl-Verhältnis der Ionenarten zueinander an. Daher spricht man bei den Salzen von Verhältnisformeln. Sinnvoll, aber nicht gebräuchlich ist zur Unterscheidung von Summenformel und Verhältnisformel die Benutzung von geschweiften Klammern für Verhältnisformeln. Also: {ZnCl2}.
Siehe auch: "Von der Wertigkeit zum Reaktionsschema"
4. Reaktionsschema in Ionenformelschreibweise
Beispiel:
2 HCl(l) + Zn → Zn2+Cl-2 + H2 / exotherm
Siehe auch: Auf dem Weg zum Reaktionsschema (2)
5. Reaktionsschema in detaillierter Ionenformelschreibweise
Beispiel:
2 H+(aq) + 2 Cl-(aq) + Zn → Zn2+(aq) + 2 Cl-(aq) + H2 / exotherm
Zinkchlorid ist wasserlöslich!
Siehe auch: Anleitung bzw. Beispiele zum Aufstellen von Reaktionsschemata in Ionenformelschreibweise
6. Reaktionsschema in Strukturformelschreibweise
(Lewisformelschreibweise, Valenzstrichformelschreibweise)
Beispiel:
Reinstoff
Reinstoff bedeutet, dass nur ein Stoff vorhanden ist.
Im Becherglas (1) sind zwei Reinstoffe enthalten, die nicht miteinander vermengt (vermischt) wurden.
Im Becherglas (2) hingegen haben wir keinen Reinstoff mehr, da die beiden Reinstoffe miteinander vermengt (vermischt) wurden: Wir haben ein Gemisch! Ein Gemisch enthält also Reinstoffe, die miteinander vermengt wurden.
Siehe auch Gemisch!Lex
Radikale
S
nach oben
Salzbildungsarten
Salze sind Ionenverbindungen und können chemisch auf unterschiedliche Arten hergestellt werden.
Strukturformelschreibweise und Summenformelschreibweise
Eine Summenformel zeigt folgende Informationen auf:
- Welche Atomsorten (Elemente) in der kleinsten Baueinheit des Stoffes miteinander gebunden sind.
- Wie viele Atome jeder Atomsorte sich in der kleinsten Baueinheit des Stoffes befinden.
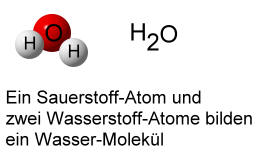
Bespiel: H2O
In einem Wasser-Molekül sind zwei Wasserstoff-Atome und ein Sauerstoff-Atom enthalten.
Darüber hinaus zeigt eine Strukturformel (Lewis-Formel, Valenzstrich-Formel):
-
- Wie die einzelnen Atome miteinander verknüpft sind:
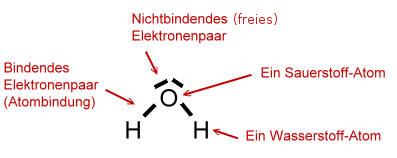
(Ein Strich = 2 ElektronenLex = Ein Elektronenpaar).
Sauerstoff steht im Periodensystem der Elemente (PSE) in der 6. Hauptgruppe (Spalte). Das bedeutet, dass ein Sauerstoff-Atom 6 Valenzelektronen (Außenelektronen) besitzt.

(Ein Punkt = 1 Elektron).
Atome sind bemüht eine voll besetzte Valenzschale (Außenschale) aufzubauen, wie es bei den Edelgas-Elementen der Fall ist (Edelgaskonfiguration). Auf der Valenzschale des Sauerstoff-Atoms passen 8 Elektronen (Oktettregel). Somit bräuchte das Sauerstoff-Atom noch zwei Elektronen.
Ein Wasserstoff-Atom besitzt nur ein einziges Valenzelektron (1. Hauptgruppe):
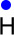
Das Wasserstoff-Atom besitzt eine sehr kleine Valenzschale, auf der nur zwei Elektronen Platz finden. Ein Wasserstoff-Atom benötigt also noch ein weiteres Elektron, um die Edelgaskonfiguration zu erhalten.
Zwei Wasserstoff-Atome und ein Sauerstoff-Atom gehen deshalb eine Verbindung ein, weil jedes Atom durch die Mitbenutzung von Elektronen eines anderen Atoms, also durch die gemeinsame Benutzung von Elektronen (= Atombindung, Elektronenpaarbindung, kovalente Bindung) die Edelgaskonfiguration erhält:
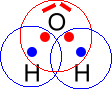
Detaillierte Strukturformel:
Bei einer detaillierten Strukturformel werden darüber hinaus Teilladungen (Partialladungen) eingezeichnet, die aufgrund von ElektronegativitätsdifferenzenLex auftreten. Ist die Elektronegativitätsdifferenz von zwei Bindungspartnern größer als 0,5, so liegt keine reine Atombindung mehr vor, sondern eine polare Atombindung. Dies hat weitreichende Auswirkungen auf die Eigenschaften des Stoffes.
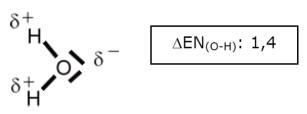
-
- Kontext: Strukturformel von Wasserstoff (Wasserstoff-Molekül)
- Kontext: Strukturformel von Sauerstoff (Sauerstoff-Molekül)
- Kontext: Strukturformel von Wasser
- Kontext: Strukturformel von Kohlenstoffdioxid
- Kontext: Strukturformel von Kohlensäure
- Kontext: Strukturformeln des Carbonat-Ions (mesomere Grenzformeln)
- Kontext: Strukturformel von Chlorwasserstoff
- Kontext: Strukturformel von Schwefelsäure
Surface Link
Ein Surface Link verweist auf die Eingangs- bzw. Hauptseite einer Website, während ein Deep Link auf eine tieferliegende Unterseite verweist. Als Hot Link wird die Einbettung von Inhalten bezeichnet, die auf einem anderen Host gespeichert sind.
Synthese
Synthese bedeutet Herstellung. Aus mindestens zwei Ausgangsstoffen (Edukte) lassen sich neue Reaktionsprodukte synthetisieren, also herstellen.
Systeme
T
nach oben
Temperatur
Thermodynamische Temperatur:
Formelzeichen: T; SI-Einheit: Kelvin, K
Empirische Temperatur ("Celcius-Temperatur"):
[Keine SI-Einheit!] Formelzeichen: θ
Zusammenhang:
θ/°C = T/K - 273,15
-
- Kontext: Gasbrenner
- Kontext: Teilchenmodell - Aggregatzustände
Temperaturen im Vergleich:
|
In Kernfusionsreaktoren
|
ca. 100 Millionen °C
|
|
|
Im Kern der Sonne
|
ca. 15 Millionen °C
|
|
|
Im Erdkern
|
ca. 7000 °C
|
|
|
An der Oberfläche der Sonne
|
ca: 6000 °C
|
|
|
Eisen schmilzt
|
1535 °C
|
Kontext: Hochofenprozess |
|
Lava
|
ca. 1200 °C :
|
Kontext: Schwefel |
|
Teclubrenner
|
ca. 1200 - 1500°C
|
Kontext: Laborgeräte |
|
Bunsenbrenner
|
ca. 1000°C
|
Kontext: Laborgeräte |
|
Streichholzflamme
|
ca. 800 °C
|
Kontext: Schwefel |
|
Eisen fängt an zu glühen
|
ca. 800 °C
|
Kontext: Hochofenprozess |
|
Speisesalz schmilzt
|
ca. 800 °C
|
Kontext: |
|
Glühende Herdplatte
|
ca. 400°C
|
Kontext: Leidenfrost-Effekt |
|
Bügeleisen
|
230 °C
|
|
|
Tagestemperatur auf dem Mond
|
130 °C
|
|
|
Wasser siedet und wird zu Wasserdampf
|
100 °C
|
|
|
Höchste Wettertemperatur
|
59 °C
|
|
|
Normale Körpertemperatur eines Menschen
|
36-37 °C
|
|
|
Eis schmilzt, Wasser erstarrt zu Eis
|
0 °C
|
|
|
Das Gas Kohlenstoffdioxid erstarrt zu Trockeneis
|
-78 °C
|
|
|
Tiefste Wettertemperatur
|
-94 °C
|
|
|
Nachttemperatur auf dem Mond
|
-130 °C
|
|
|
Die Luft kondensiert und wird flüssig
|
-194 °C
|
|
|
Temperatur im leeren Raum (Universum)
|
-270 °C
|
|
|
Absoluter Nullpunkt - tiefstmögliche Temperatur
|
-273,15 °C (= 0 Kelvin)
|
|
U
nach oben
V
nach oben
Valenzelektronen
Als Valenzelektronen bezeichnet man diejenigen Elektronen, die sich auf der äußersten Schale, der sogenannten Valenzschale, befinden.
Verbindung
Merke:
Verbindungen sind Reinstoffe, die aus unterschiedlichen Atomsorten (Elementen) bestehen.
Eine Verbindung ist ein Reinstoff, der sich in ElementeLex zerlegen lässt. Reines Wasser zum Beispiel lässt sich mit Hilfe von Strom in die Elemente Wasserstoff und Sauerstoff zerlegen.
Wichtig: Eine Verbindung hat nichts mehr mit den Elementen zu tun. Eine Verbindung besitzt völlig andere Eigenschaften als die Elemente aus denen sie "zusammengesetzt" ist: Wasser z.B. hat völlig andere Eigenschaften als Wasserstoff und Sauerstoff.
Viskos
Die Viskosität ist die Zähflüssigkeit eines Stoffes. Honig ist z.B. sehr viskos.
W
nach oben
Wasserstoff
"Wasserstoffbrücken"
(der Begriff ist in Klammern gesetzt, weil es sich nicht um eine wirkliche Brücke handelt)
Oft in der Literatur auch als Wasserstoffbrücken-Bindung bezeichnet. Für die Schulchemie bevorzuge ich den Begriff "Bindung" in diesem Zusammenhang nicht zu nennen (siehe auch Beitrag im Forum).
Bei einer "Wasserstoffbrücke" handelt es sich um eine nicht kovalente Wechselwirkung (Anziehungskraft) zwischen zwei Molekülen (= intermolekulare "Wasserstoffbrücke") oder auch innerhalb eines Moleküls (= intramolekulare "Wasserstoffbrücke"). Es ist eine im Vergleich zu einer Atombindung (kovalente Bindung, Elektronenpaarbindung) recht schwache Anziehungskraft, die schon durch relativ geringe Temperaturerhöhung in ihrer Wirkung stark beeinflusst wird.
Hauptkriterium ist die Wechselwirkung zwischen einem stark polarisiertem Wasserstoff-Atom, δ+, (daher auch der Name dieser Wechselwirkung) und einem nicht bindendem Elektronenpaar eines anderen Moleküls - wobei das Atom, welches das nichtbindende Elektronenpaar besitzt, eine negative Teilladung trägt (δ-). Diese Wechelwirkung wird gewöhnlich mit einer punktierten oder "schraffierten" Linie verdeutlicht. Als partiell negativ geladenes Atom mit mindestens einem nicht bindendem Elektronenpaar kommen hauptsächlich folgende Atome in Frage:
Sauerstoff, Stickstoff, Schwefel und die Halogene.
Hier die wichtigsten "Wasserstoffbrücken" mit ihren Bindungsenergien (nach Römpp, USB-Stick, 2008):
"Wasserstoffbrücken" sind ein Sonderfall von Dipol-Dipol-WechselwirkungenLex .
Siehe auch "zwischenmolekulare Wechelwirkungen" Lex
Wertigkeit
Mit Hilfe der Wertigkeit (oder auch Bindigkeit) kannst du das Teilchenverhältnis der kleinsten Baueinheit einer Verbindung bestimmen. Erst wenn du das beherrschst, kannst du alle chemischen ReaktionsschemataLex aufstellen.
In der Tabelle findest du die Wertigkeiten der wichtigsten Elemente und eine Anleitung zur Bestimmung.
Einige Elemente können verschiedene Wertigkeiten haben [insbesondere die so genannten Übergangsmetalle (siehe auch PSE)].
X
nach oben
Y
nach oben
Z
nach oben
Zwischenmolekulare Wechselwirkungen







 1776-1856
1776-1856


 Als Summenformel bzw. Halbstrukturformel: R-OH
Als Summenformel bzw. Halbstrukturformel: R-OH Als Summenformel bzw. Halbgrukturformel: R-CO-R
Als Summenformel bzw. Halbgrukturformel: R-CO-R












